Ogļūdeņraži
Ogļūdeņraži
13. Alkēnu fizikālās un ķīmiskās īpašības
Fizikālo īpašību ziņā alkēni ir līdzīgi alkāniem.
Alkēni ūdenī praktiski nešķīst, bet šķīst organiskajos šķīdinātājos. Alkēni pieder pie nepolāriem hidrofobiem savienojumiem. Palielinoties alkēnu molekulmasai, to viršanas temperatūras pieaug. Dažāda veida izomēriem ir atšķirīgas viršanas temperatūras.
Alkēni ir ķīmiski aktīvāki par alkāniem. Tas izskaidrojams ar divkāršās saites C=C klātieni. Lielāka reaģētspēja ir p saitei, jo šīs saites elektroniem ir lielāka enerģija nekā vienkāršās jeb s saites elektroniem.
1. Reakcijas ar halogēniem
Etēnam reaģējot ar bromu ūdens vai dihlormetāna šķīdumā, novēro šķīduma atkrāsošanos. Ar indikatoru var pārliecināties, ka bromūdeņradis neizdalās. Tātad ir notikusi pievienošanas reakcija. Abi broma atomi pievienojas alkēna molekulai, pārtrūkstot p saitei. Reakcijā veidojas tikai viens reakcijas produkts - 1,2-dibrometāns:
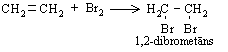
Alkēni līdzīgi reaģē arī ar hloru, veidojot dihloralkānus:
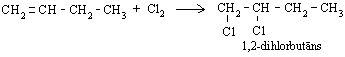
2. Halogēnūdeņražu pievienošana
Alkēni reaģē ar visiem halogēnūdeņražiem. Alkēniem pievienojot fluorūdeņradi vai jodūdeņradi, var iegūt attiecīgos fluoralkānus un jodalkānus:
3. Ūdens pievienošana
Ūdens pievienošanās rezultātā veidojas spirti:
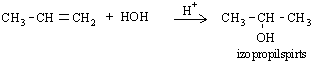
Propēna reakciju ar ūdeni izmanto rūpniecībā izopropilspirta iegūšanai.
Laižot pār katalizatoru etēna un ūdens tvaika maisījumu, iegūst etilspirtu.
4. Hidrogenēšana
Alkēniem ūdeņradis pievienojas katalizatora (Ni, Pd, Pt) klātienē:
![]()
Šajās reakcijās rodas alkāni. Alkēnu hidrogenēšanai nav plaša pielietojuma, jo tajā no sarežģītāka savienojuma iegūst vienkāršāku.
5. Oksidēšana
Oksidējot alkēnus ar kālija permanganātu vāji sārmainā vidē, iegūst divvērtīgos spirtus:
![]()
Alkēni, it sevišķi gāzveida un viegli gaistošie alkēni, līdzīgi alkāniem deg. Alkēni deg ar viegli kūpošu liesmu, izdalot lielu enerģijas daudzumu.
![]()
6. Polimerizācija
Katalizatora klātbūtnē un paaugstinātā temperatūrā alkēnu molekulas var savienoties cita ar citu, veidojot garas virknes. Polietēna, ko parasti sauc par polietilēnu, veidošanos no etēna shematiski var attēlot šādi:
![]()
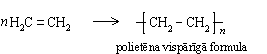
Līdzīgi etēnam polimerizējas arī propēns:
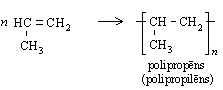
Alkēnu pierādīšana
Alkēnu divkāršās saites pierādīšanai parasti izmanto reakciju ar broma šķīdumu ūdenī vai dihlormetānā. Papildus var izmantot arī oksidēšanu ar kālija permanganāta šķīdumu, lai gan daudzi citi organiskie savienojumi šādos apstākļos arī var oksidēties. Oksidēšanu veic bāziskā vidē. Abās reakcijās novēro šķīdumu atkrāsošanos. Reakciju vienādojumus skat. iepriekš.