Ogļūdeņraži
| Site: | Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu kompetences paaugstināšana |
| Course: | ĶīmiT026 : Mūsdienīgs un atvērts mācību process ķīmijā profesionālajā izglītībā |
| Book: | Ogļūdeņraži |
| Printed by: | Guest user |
| Date: | Friday, 27 February 2026, 8:54 PM |
Description
Ogļūdeņraži
Table of contents
- 1. Titullapa
- 2. Ievads
- 3. Ogļūdeņražu iedalījums
- 4. Alkānu homologu rindas pirmie pārstāvji
- 5. Kā var pierakstīt alkānu formulas?
- 6. Patstāvīgais darbs. Alkānu nosaukumi
- 7. Patstāvīgais darbs. Alkānu formulas un nosaukumi
- 8. Alkānu fizikālās īpašības
- 9. Laboratorijas darbs. Alkānu fizikālās īpašības
- 10. Patstāvīgais darbs. Alkānu agregātstāvoklis
- 11. Alkānu ķīmiskās īpašības
- 12. Alkāni praktiskajā dzīvē
- 13. Alkēnu fizikālās un ķīmiskās īpašības
- 14. Demonstrējums. Etēna iegūšana, depolimerizējot polietilēnu
- 15. Riski un problēmas
1. Titullapa



D.Cēdere
Ogļūdeņraži
Materiāls izstrādāts
ESF Darbības programmas 2007. - 2013.gadam „Cilvēkresursi un nodarbinātība”
prioritātes 1.2. „Izglītība un prasmes”
pasākuma 1.2.1.„Profesionālās izglītības un vispārējo prasmju attīstība”
aktivitātes 1.2.1.2. „Vispārējo zināšanu un prasmju uzlabošana”
apakšaktivitātes 1.2.1.1.2. „Profesionālajā izglītībā iesaistīto pedagogu
kompetences paaugstināšana”
Latvijas Universitātes realizētā projekta
„Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu
kompetences paaugstināšana”
(Vienošanās Nr.2009/0274/1DP/1.2.1.1.2/09/IPIA/VIAA/003,
LU reģistrācijas Nr.ESS2009/88) īstenošanai.
Rīga, 2010
2. Ievads
|
Ogļūdeņraži ir vienkāršākie organiskie savienojumi. Dabā ogļūdeņraži ir sastopami naftā un dabasgāzē. Dabasgāze un naftas pārstrādes galvenais produkts - benzīns ir mūsu ikdienas nepieciešamība. |
Sasniedzamais rezultāts
• Zina jēdzienus: ogļūdeņraži, alkāni, alkēni, alkīni, arēni.
• Izprot ogļūdeņražu uzbūvi. Ar konkrētiem piemēriem paskaidro alkānu, alkēnu, alkīnu un arēnu izomērijas veidus, sastāda izomēru formulas konkrētam ogļūdeņradim.
• Raksturo homoloģijas būtību, uzraksta ogļūdeņražu homologus pēc to rindu vispārīgajām formulām, nosauc ogļūdeņražus atbilstoši Starptautiskajai (IUPAC) nomenklatūrai.
• Klasificē ogļūdeņražus (alkāni, alkēni, alkīni, arēni).
• Izprot ogļūdeņražu degšanas reakcijas.
• Izprot alkānu un arēnu aizvietošanas reakcijas.
• Izprot alkēnu, alkīnu un arēnu pievienošanas reakcijas.
• Izprot alkēnu polimerizācijas reakciju.
• Raksta reakciju vienādojumus (atbilstoši prasītajiem reakciju veidiem) homologu rindu vispārīgajam loceklim, kas raksturo alkānu, alkēnu, alkīnu un arēnu īpašības.
• Zina sastāvu, svarīgākās sastāvdaļas un lietošanas principus ikdienā lietojamiem šķīdinātājiem.
• Raksturo dabasgāzes, akmeņogļu un naftas pārstrādes virzienus, pārstrādē iegūtos produktus un to nozīmi.
• Zina ogļūdeņražu nozīmi izvēlētajā profesijā.
Metodiskas norādes skolotājam
Audzēkņi jau pazīst dabasgāzi, šķiltavu gāzi, benzīnu un citus sadzīvē lietojamus ogļūdeņražus. Zina oglekļa vērtību organiskajos savienojumos un ir priekšstats par organisko savienojumu molekulu uzbūvi.
Šajā nodaļā tiks apskatīti svarīgākie ogļūdeņraži, to atrašanās dabā, īpašības un izmantošana. Galvenā vērība tiks veltīta tiem ogļūdeņražiem, kuri ir svarīgi praktiskajā dzīvē. Ar ogļūdeņražiem nākas sastapties praktiski visu profesiju pārstāvjiem – frizieriem, pavāriem, automehāniķiem, namdariem, celtniekiem u.c.
Apgūstot šo tematu, ieteicams audzēkņiem parādīt ogļūdeņražu paraugus, ar kuriem sastopamies ikdienā, piemēram, šķiltavu gāzi, benzīnu, “vaitspiritu”. Visi šie ogļūdeņraži ir alkāni. No visiem ogļūdeņražiem ikdienā visvairāk izmantojam alkānus (to tehniskajiem produktiem var būt nelieli citu ogļūdeņražu piemaisījumi). Ogļūdeņražu izmantošanas veidi pamatā ir divi:
• enerģijas ieguvei, tos sadedzinot (dabasgāze, propāns-butāns, benzīns, dīzeļdegviela);
• par šķīdinātājiem (šķidrie alkāni).
Svarīgi uzsvērt, ka visi šķidrie un gāzveida ogļūdeņraži ir ugunsbīstami un var viegli aizdegties.
Svarīgākie ogļūdeņraži ir alkāni, kas ir visbiežāk sastopami, un alkēni, kas ir izejviela polietilēna iegūšanai. Tāpēc, iepazīstoties ar ogļūdeņražiem vispirms labi jāizprot alkānu molekulu uzbūve, izomērija, iegūšana, fizikālās un ķīmiskās īpašības (PP Alkāni) un alkēnu molekulu uzbūve, izomērija, fizikālās un ķīmiskās īpašības (PP Alkēni).
Citi metodiskie materiāli:
• Ogļūdeņražu formulu rakstīšanas un nosaukumu veidošanas apguvei – patstāvīgie darbi, kas veicami stundā: DL Alkānu formulas un nomenklatūra, DL Alkānu nomenklatūra.
• Izpratnes veidošanai par ogļūdeņražu fizikālajām īpašībām – pastāvīgais darbs stundā un laboratorijas darbs: DL Alkānu agregātstāvoklis,
DL Alkānu fizikālās īpašības.
• Etēna iegūšana: DL Etēna iegūšana.
• Pārskats par ogļūdeņražu izmantošanu: PP Ogļūdeņraži sadzīvē.
3. Ogļūdeņražu iedalījums
4. Alkānu homologu rindas pirmie pārstāvji
5. Kā var pierakstīt alkānu formulas?
Organisko savienojumu molekulu uzbūvi (struktūru) parāda molekulu struktūrformulas, kuras var attēlot dažādi. Alkānu, līdzīgi kā citu organisko savienojumu molekulu struktūras attēlošanai, parasti izmanto struktūrformulas, kurās raksta visus to sastāvā ietilpstošos atomus. Alkānus attēlojot ar pilnajām struktūrformulām, starp C un H atomiem parāda arī visas saites. Rakstot reakciju vienādojumus, parasti attēlo tikai svarīgākās saites, tas vienkāršo pierakstu un padara to uzskatāmāku.
Sarežģītāku savienojumu struktūras attēlošanai ieteicams izmantot t.s. saīsinātās struktūrformulas. Saīsinātajās struktūrformulās parāda tikai saites starp atomiem, bet pašus atomus neraksta. Oglekļa atomu virkni alkānos attēlo zig-zag līnijas veidā, kas vienlaikus labi atbilst patiesajam oglekļa atomu stāvoklim alkānu molekulās. Saīsinātās struktūrformulas ir uzskatāmākas (skat. tabulu).
6. Patstāvīgais darbs. Alkānu nosaukumi
(Skat. DL Alkānu nosaukumi)
Audzēkņiem sasniedzamais rezultāts
- Izpratne par alkānu molekulu uzbūvi un struktūrformulām.
- Prasme nosaukt alkānus, izmantojot IUPAC nomenklatūru.
Uzdevums
Pamato, ka katras rindas visas formulas attēlo vienas un tās pašas molekulas uzbūvi! Nosauc savienojumus! Sastādi molekulu modeļus!
 (nosaukums: propāns)
(nosaukums: propāns)
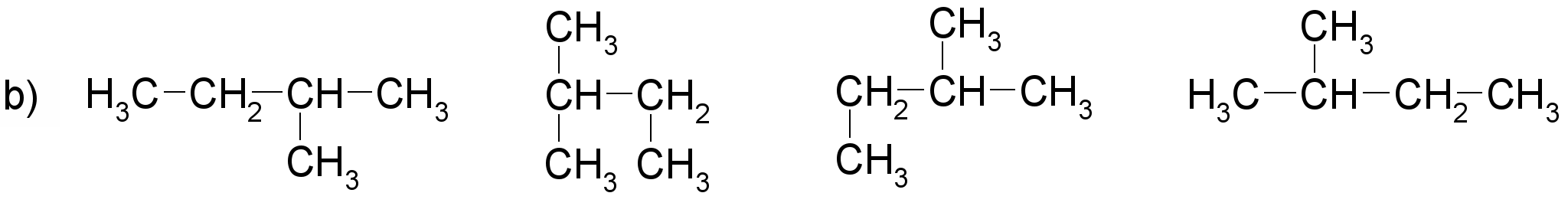
(nosaukums: 2-metilbutāns)
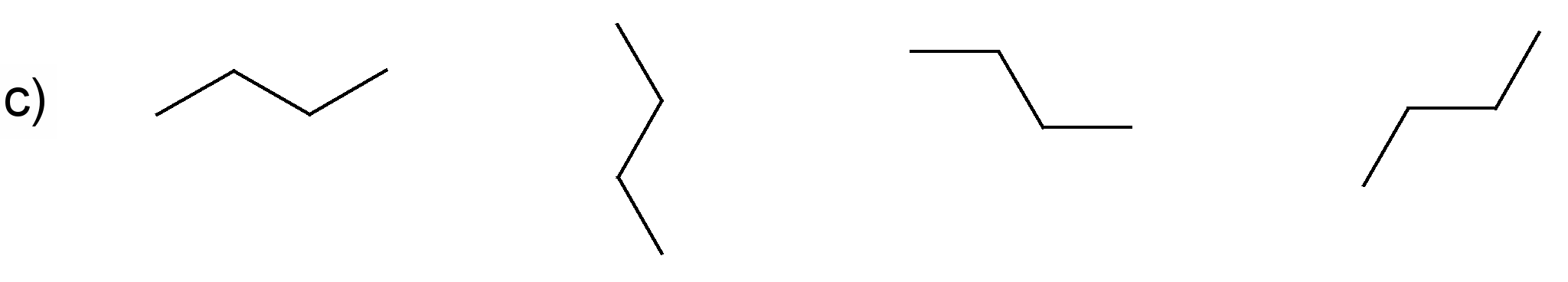
(nosaukums: butāns)

(nosaukums: 2-metilbutāns)
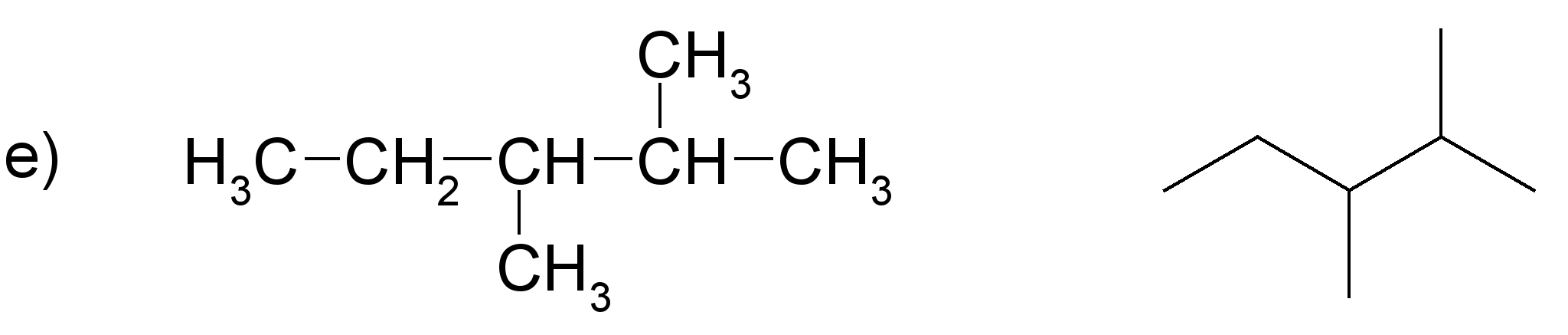
(nosaukums: 2,3-dimetilpentāns)
Metodiskas piezīmes
Darbam var izmantot gatavus atomu modeļus. Ieteicams izvēlēties lodīšu-stienīšu modeļus, lai sastādītajos molekulu modeļos būtu redzamas saites starp atomiem. Apskatot šādus alkānu modeļus, var labi saskatīt oglekļa atomu virknes zig-zag formu. Ierosiniet audzēkņiem paņemt modeli rokās un mēģināt novietot to tā, kā ir attēlotas struktūrformulas. Pievērsiet skolēnu uzmanību tam, ka no molekulas novietojuma telpā nemainās atomu secība molekulā, tāpēc katrā variantā visas struktūrformulas atbilst vienam savienojumam.
Darba beigās zināšanu nostiprināšanai der pajautāt, kuras formulas precīzāk attēlo molekulu patieso uzbūvi (struktūru).
Ja nav atomu modeļu, tos audzēkņi var izgatavot paši no plastilīna un sērkociņiem vai cita materiāla. Tad šo darbu ieteicams uzdot kā mājas darbu.
7. Patstāvīgais darbs. Alkānu formulas un nosaukumi
(Skat. DL Alkānu formulas un nosaukumi)
Audzēkņiem sasniedzamais rezultāts
- Izprot dažādus alkānu molekulu pieraksta veidus.
- Prot lietot alkānu struktūrformulas un nosaukumus.
- Prot lietot zināšanas par izomēriju.
Darba uzdevumi
1. Aizpildīt tabulu, tukšajās vietās ierakstot trūkstošo alkāna formulu vai nosaukumu.
2. Tabulā sameklēt, kuri savienojumi savā starpā ir izomēri?
Metodiskas piezīmes
Patstāvīgais darbs izmantojams zināšanu nostiprināšanai.
8. Alkānu fizikālās īpašības
Tā kā alkānu molekulās visas saites ir nepolāras kovalentās saites, alkāni ir nepolāri savienojumi. Ar to ir izskaidrojama to šķīdība nepolāros šķīdinātājos, piemēram, tetrahlormetānā (tetrahlorogleklī) un nesajaukšanās ar ūdeni (izņēmums ir metāns un etāns, kuri gan ļoti maz, tomēr šķīst ūdenī). Alkāni ir hidrofobi* savienojumi. Tas nozīmē, ka alkānu molekulas atgrūžas no ūdens molekulām, jo mijiedarbības spēki starp viena veida molekulām ir daudz lielāki nekā iespējamā saistība starp alkāna molekulu un ūdens molekulu. Savukārt šķidrie alkāni (heksāns, heptāns) labi šķīdina citas nepolāras vielas, piemēram, taukus un eļļas.
Organisko vielu savstarpējo šķīdību raksturo teiciens “līdzīgs šķīst līdzīgā”.
Alkāni ar oglekļa atomu skaitu 1-4 istabas temperatūrā ir gāzveida vielas. Alkāni C5 – C16 ir šķidrumi ar petrolejai līdzīgu smaržu. Augstākie alkāni ir cietas vielas (līdzīgas parafīnam) bez smaržas.
Alkānu fizikālo īpašību raksturojums
|
Nosaukums |
Molekul-formula |
Kušanas temperatūra (oC) |
Viršanas temperatūra (oC) |
Agregātstāvoklis 20 oC temperatūrā |
|
Metāns Etāns Propāns Butāns Pentāns Heksāns Heptāns Oktāns Nonāns Dekāns ... Pentadekāns Heksadekāns Heptadekāns ... Eikozāns |
CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 ... C15H32 C16H34 C17H36 ... C20H42 |
-182,5 -183,2 -187,1 -135 -129,7 -94,3 -90,5 -56,5 -53,7 -29,7 ... +10,0 +18,1 +22,0 ... +36,4 |
-161,4 -88,5 -42,1 -0,5 +36,2 +68,7 +98,4 +125,8 +150,7 +174,0 ... +268,0 +280,0 +303,0 ... +345,1 |
gāze gāze gāze gāze šķidrums šķidrums šķidrums šķidrums šķidrums šķidrums ... šķidrums šķidrums cieta viela ... cieta viela |
9. Laboratorijas darbs. Alkānu fizikālās īpašības
(Skat. DL Alkānu fizikālās īpašības)
Mērķis. Iepazīties ar alkānu fizikālajām īpašībām.
Audzēkņiem sasniedzamais rezultāts
- Pazīst šķidros alkānus.
- Prot veikt vienkāršus eksperimentus.
- Prot izdarīt novērojumus un secinājumus.
- Zina jēdzienu hidrofobs.
1. Alkānu atšķirīgā gaistamība
Uzmanību! Veicot šo eksperimentu, telpā nedrīkst būt atklāta liesma. Traukiem, no kuriem tiek ņemti paraugi, jābūt noslēgtiem.
Darba piederumi, vielas: benzīns, ūdens; 3 Petri trauciņi vai pulksteņstikliņi.
Darba gaita
Vienā Petrī trauciņā iepilina 2-3 pilienus benzīna, otrā - tikpat vaitspirita, bet trešajā - ūdens. Salīdzina gaistamību.
Metodiskas piezīmes
Palielinoties alkānu virknes garumam, alkāni kļūst mazāk gaistoši, jo starp lielākām molekulām pastāv stiprāki starpmolekulārie pievilkšanās spēki. Šo eksperimentu var demonstrēt uz kodoskopa.
2. Alkānu izturēšanās pret ūdeni
Darba piederumi, vielas: benzīns, ūdens; mēģene ar aizbāzni, flomasters.
Darba gaita
1. Mēģeni apmēram līdz trešdaļai piepilda ar ūdeni, pievieno 1 ml benzīna. Mēģeni noslēdz ar aizbāzni un ar flomasteru atzīmē slāņu robežlīniju.
2. Mēģeni saskalina un ļauj nostāties. Novēro, vai robežlīnijas vieta ir mainījusies.
Novēro, ka pēc saskalināšanas robežlīnija starp abiem šķidrumiem nav mainījusies, tātad abi šķidrumi nejaucas jeb nešķīst viens otrā. Secina, ka benzīns ir vieglāks par ūdeni un tajā praktiski nešķīst.
Svarīgi ir veidot izpratni par to, ka šķīšana pieder pie vielu fizikālajām īpašībām, kaut arī, precīzāk runājot, tas ir fizikāli ķīmisks process.
Fakts, ka alkāni (piemēram, benzīns) ir vieglāki par ūdeni un tajā nešķīst, ir jāņem vērā, ja ir notikusi aizdegšanās un ir jādzēš liesmas.
Benzīna vietā var ņemt heksānu vai vaitspiritu.
3. Alkāni – labi šķīdinātāji
Darba piederumi, vielas: heksāns, tauki vai pārtikas eļļa; mēģene.
Darba gaita
1. Mēģenē ielej 1-2 mililitrus heksāna un ievieto tauku piciņu vai ielej dažus pilienus pārtikas eļļas.
2. Saskalina. Veidojas dzidrs šķīdums.
Metodiskas piezīmes
Šķidrie alkāni ir svarīgi šķīdinātāji. Tajos labi šķīst nepolāras vielas – tauki, eļļas. Eksperimentam nepieciešamas sausas mēģenes.
Šajā eksperimentā nav ieteicams izmantot sviestu vai margarīnu, jo tie satur ūdeni (~20%), tāpēc neveidojas dzidrs šķīdums.
Heksāna vietā var izmantot benzīnu.
Jautājumi audzēkņu izpratnes pārbaudei
1. Kura viela ir vairāk gaistoša – pentāns vai heptāns?
2. Cik liels ir ūdens blīvums? Salīdziniet alkānu blīvumu ar ūdens blīvumu! Kā par to var pārliecināties eksperimentāli?
3. Kādas vielas šķīst heksānā un kādas nešķīst? Nosauciet piemērus.
4. Kāpēc benzīns nejaucas ar ūdeni?
5. Aprakstiet šķidro alkānu ārējo izskatu!
10. Patstāvīgais darbs. Alkānu agregātstāvoklis
(Skat. DL Alkānu agregātstāvoklis)
Audzēkņiem sasniedzamais rezultāts
- Prot rakstīt alkānu molekulformulas.
- Prot izmantot grafikus.
- Izprot fizikālo īpašību maiņu alkānu homologu rindā.
- Izprot sakarību starp alkāna viršanas temperatūru un ugunsbīstamību.
Darba uzdevumi
- Uzrakstīt alkānu molekulformulas, ja dots C atomu skaits.
- Izmantojot grafiku, atrast, kā izmainās alkānu kušanas un viršanas temperatūras atkarībā no C atomu skaita molekulā.
- Pēc dotā grafika pateikt, kādā agregātstāvoklī istabas temperatūrā ir etāns?
- Izmantojot grafiku, uzrakstīt trīs alkānu molekulformulas, kuri istabas temperatūrā ir šķidrā stāvoklī.
- Kāda sakarība pastāv starp vielas viršanas temperatūru un ugunsbīstamību?
Metodiskas piezīmes
Darbs ar grafikiem bieži vien skolēniem sagādā problēmas. Šis grafiks vizualizē svarīgu likumsakarību - sakarību starp molekulas lielumu un vielas agregātstāvokli vienas savienojumu klases ietvaros.
Audzēkņiem izpildāmos uzdevumus var koriģēt vai mainīt pēc skolotāja ieskatiem.
11. Alkānu ķīmiskās īpašības
Alkānu vēsturiskais nosaukums ir parafīni*, jo parastajos apstākļos tie nereaģē ne ar koncentrētām neorganiskajām skābēm, ne sārmiem, ne arī ar spēcīgiem oksidētājiem, piemēram, ar kālija permanganātu. Tomēr karsējot un ultravioletā starojuma iedarbībā alkāniem ir raksturīgas reakcijas ar reaģentiem, kam piemīt liela enerģija.
Oksidēšanās. Alkānu raksturīga īpašība ir oksidēšanās ar skābekli - degšana. Šī reakcija, aizdedzinot ogļūdeņradi gaisa skābekļa klātbūtnē, notiek ļoti strauji:
12. Alkāni praktiskajā dzīvē
Metāns CH4
Tā ir gāze bez krāsas un bez smaržas, viegli degoša (viršanas temperatūra ir -164 °).
* Ar 2010. gadu Latvijā sāk ieviest jaunu ķīmisko vielu klasificēšanas sistēmu - GHS (Globāli harmonizēto sistēmu), kas būs vienota visā pasaulē.
Skat. http://www.lvgma.gov.lv/chemical/CLP_majas_lapai_pamatteksts.htm
Metāns ir galvenā dabasgāzes sastāvdaļa (85-95%).
Dabasgāzi izmanto galvenokārt ēdiena gatavošanai un mājokļu apsildīšanai. Lietojot metānu par deggāzi ikdienā, jāuzmanās, lai nerastos gāzes noplūde, jo metāns maisījumā ar gaisu var izraisīt eksploziju.
|
Metāna saturs gaisā (tilpuma %) |
Degšanas intensitāte |
|
5 – 15 > 15 < 5 |
Spēcīga eksplozija Deg mierīgi Nevar aizdedzināt |
Metāns uzkrājas arī akmeņogļu raktuvēs. Ja raktuves netiek pietiekami vēdinātas, veidojas eksplozīvs metāna un gaisa maisījums, kas nereti ir izraisījis smagus raktuvju nogruvumus un prasījis arī cilvēku upurus. Metāna un gaisa maisījums var aizdegties pat no īssavienojuma elektrības vados.
Tā kā metānam nav smaržas, deggāzei pievieno nedaudz sērsaturoša organiskā savienojuma ar asu, nepatīkamu smaku, pēc kuras var viegli konstatēt bojājumus gāzesvados.
Metāns ir arī vērtīga un lēta izejviela ķīmiskajā rūpniecībā.
Sadzīvē izmantojamie metāna homologi
Etānu izmanto etilēna iegūšanai.
Propānu un propāna un butāna maisījumu ikdienā lieto par deggāzi, ko sašķidrinātu transportē balonos.
Petrolēteris ir alkānu (galvenokārt pentānu un heksānu) maisījums, ko iegūst no viegli gaistošām naftas frakcijām un izmanto par šķīdinātāju.
Heksāns un oktāns ietilpst dažādu degvielu (benzīna, dīzeļdegvielas) sastāvā un tiek lietoti par šķīdinātājiem. Tie ir viegli degoši, nejaucas ar ūdeni.
Vazelīneļļa ir alkānu maisījums līdz C15, to izmanto medicīnā un parfimērijā, kā arī tehnikā par ziežvielu, kas samērā grūti oksidējas.
Vazelīns ir cieto alkānu (līdz C25) maisījums. Izmanto medicīnā ziežu pagatavošanai.
Galvenā daudzu tehnikā izmantojamo vaskveida vielu sastāvdaļa ir parafīns. Tas ir daudzu cieto alkānu maisījums, kas atkarībā no C virknes garuma ir ar dažādu cietību un kušanas temperatūru. No parafīna var izgatavot sveces, ziedes, lūpkrāsas un apavu krēmus.
Dabasgāze
Dabasgāzes krājumi un to izmantošana 1991. gadā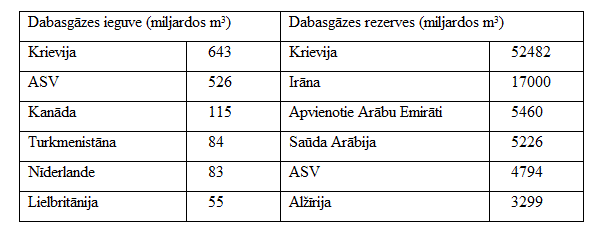
Papildinformācija:
IM Dabasgāze
http://www.lg.lv/
Visiem labi pazīstamās šķiltavas, ko var iegādāties kioskos un citās tirdzniecības vietās, ir pildītas ar kādu no naftas pārstrādes produktiem.
Šķiltavu gāze ir butāns. Šķiltavās tā atrodas zem neliela spiediena, kas ir pietiekams, lai butāns, kura viršanas temperatūra ir –0,5 oC, atrastos šķidrā stāvoklī. Šķidrā stāvoklī butāns aizņem daudz mazāku tilpumu nekā tad, ja tas būtu gāzveida stāvoklī (Avogadro likums).


Gāzes baloniņš šķiltavu uzpildīšanai.
Uzmanību! Šķiltavu gāze ir īpaši viegli uzliesmojoša!
Šķiltavu benzīns

Šķiltavu benzīns ir naftas destilācijas vieglās frakcijas ar zemu viršanas temperatūru. Pārdošanā ir dažāda fasējuma šķiltavu benzīns, kuru izmanto šķiltavu uzpildīšanai.
Šķiltavu benzīns ir īpaši viegli uzliesmojošs!
Sašķidrinātā gāze (balonu gāze, grilgāze, “campinggas”)
Sašķidrinātā gāze, ko pilda dažāda lieluma balonos, ir propāna un butāna maisījums. Sašķidrinātās gāzes galvenais izmantošanas veids – telpu apsildīšana un tehnoloģisko procesu izpildes nodrošināšana. Var iegādāties gāzi ar dažādu propāna un butāna attiecību vai tīru propānu.
Grilgāze, ko pārdod firma AGA SOL ir tīrs propāns (skat. arī AGASOL_grilgaze_broshura_4p.pdf).
 http://www.linde.com/international/web/lg/lv/like35agalv.nsf/docbyalias/nav_propane
http://www.linde.com/international/web/lg/lv/like35agalv.nsf/docbyalias/nav_propane
Gāzi pilda dažāda lieluma balonos, sākot no 5 litriem līdz pat 79 litriem (www.intergaz.lv/.../grain_dryers/).
Autogāze
 http://www.intergaz.lv/lv/for_business/gas_in_agriculture/grain_dryers/
http://www.intergaz.lv/lv/for_business/gas_in_agriculture/grain_dryers/
Autogāze ir propāna, butāna un nenozīmīga daudzuma nepiesātināto ogļūdeņražu (aptuveni 1%) maisījums. Faktiski ir divas autogāzes markas: ziemas (85-95% propāna) un vasaras (45-55% propāna) autogāze. Butānam ir augstāka viršanas temperatūra (‑0,5 0C) nekā propānam (-42 0C), tāpēc aukstā laikā propāna saturu deggāzē palielina. Tas dod iespēju visu gadu automašīnu ekspluatēt ar gāzi.
Sašķidrinātā gāze balonā atrodas zem pašas piesātināto tvaiku spiediena, kurš praktiski nav atkarīgs no gāzes daudzuma balonā. Šī īpašība dod iespēju praktiski pilnībā izlietot balona saturu. Paaugstinoties temperatūrai, spiediens balonā pieaug. Ja gāze šķidrā stāvoklī pilnībā aizpilda balonu, bet temperatūra turpina palielināties, tad pieaugošā spiediena iedarbībā balons var izjukt. Tāpēc nekad nevajag balonu pilnībā aizpildīt ar sašķidrināto gāzi - nepieciešams obligāti atstāt tvaika spilvenu, kuram jābūt 15-20% no balona tilpuma.
Papildinformācija automehāniķiem: http://www.heinrihs-gaze.lv/index.php?sadala=5
Vaitspirits

Vaitspirits (no angļu valodas white – balsts, bezkrāsains + spirit – gars), kuru sauc arī par vaitspirtu, ir augsti virstoša benzīna frakcija, ko izmanto par šķīdinātāju. Vaitspirits ir alifātisko un aromātisko ogļūdeņražu maisījums ar viršanas temperatūru 155-200 0C, ko iegūst naftas destilācijā. Vaitspiritu lieto eļļas krāsu, grīdas emalju, parketa laku, citu alkīdkrāsu un alkīdlaku atšķaidīšanai, kā virsmu attaukošanas līdzekli pirms līmēšanas, gruntēšanas un krāsošanas darbiem, kā arī instrumentu mazgāšanai. Autobraucēji to izmanto virsbūves attīrīšanai no darvas traipiem.
Vaitspiritu plaši izmanto atslēdznieki, automehāniķi un celtnieki ēku iekšdarbos.
Biogāze
Metāns veidojas visur tur, kur baktēriju iedarbībā notiek beigtu dzīvnieku un augu palieku sadalīšanās bez gaisa piekļuves. Purvos un piesārņotu ūdenstilpju dibenā veidojas purva gāze, kas ir metāna un oglekļa dioksīda maisījums.
Mūsdienās pūšanas procesu izmanto mērķtiecīgi, lai no augu valsts paliekām (kūtsmēsliem, organiskajiem atkritumiem), iegūtu biogāzi. Biogāze sastāv galvenokārt no metāna (apmēram 60%) un oglekļa dioksīda (apmēram 35%). Bez tam tā satur arī ūdeņradi, slāpekli un sērūdeņradi. Biogāzei ir augsta siltumkapacitāte.
Iegūstot biogāzi, var ietaupīt vērtīgas izejvielas un samazināt vides piesārņošanu. Ir aprēķināts, ka no organiskajiem atkritumiem, kas rodas no viena iedzīvotāja,dienā varētu iegūt 35 litrus biogāzes. Tas ļautu būtiski ietaupīt fosilo degvielu.
13. Alkēnu fizikālās un ķīmiskās īpašības
Fizikālo īpašību ziņā alkēni ir līdzīgi alkāniem.
Alkēni ūdenī praktiski nešķīst, bet šķīst organiskajos šķīdinātājos. Alkēni pieder pie nepolāriem hidrofobiem savienojumiem. Palielinoties alkēnu molekulmasai, to viršanas temperatūras pieaug. Dažāda veida izomēriem ir atšķirīgas viršanas temperatūras.
Alkēni ir ķīmiski aktīvāki par alkāniem. Tas izskaidrojams ar divkāršās saites C=C klātieni. Lielāka reaģētspēja ir p saitei, jo šīs saites elektroniem ir lielāka enerģija nekā vienkāršās jeb s saites elektroniem.
1. Reakcijas ar halogēniem
Etēnam reaģējot ar bromu ūdens vai dihlormetāna šķīdumā, novēro šķīduma atkrāsošanos. Ar indikatoru var pārliecināties, ka bromūdeņradis neizdalās. Tātad ir notikusi pievienošanas reakcija. Abi broma atomi pievienojas alkēna molekulai, pārtrūkstot p saitei. Reakcijā veidojas tikai viens reakcijas produkts - 1,2-dibrometāns:
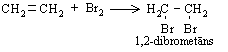
Alkēni līdzīgi reaģē arī ar hloru, veidojot dihloralkānus:
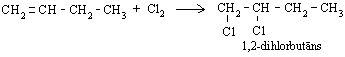
2. Halogēnūdeņražu pievienošana
Alkēni reaģē ar visiem halogēnūdeņražiem. Alkēniem pievienojot fluorūdeņradi vai jodūdeņradi, var iegūt attiecīgos fluoralkānus un jodalkānus:
3. Ūdens pievienošana
Ūdens pievienošanās rezultātā veidojas spirti:
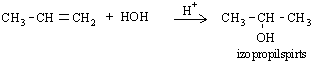
Propēna reakciju ar ūdeni izmanto rūpniecībā izopropilspirta iegūšanai.
Laižot pār katalizatoru etēna un ūdens tvaika maisījumu, iegūst etilspirtu.
4. Hidrogenēšana
Alkēniem ūdeņradis pievienojas katalizatora (Ni, Pd, Pt) klātienē:
![]()
Šajās reakcijās rodas alkāni. Alkēnu hidrogenēšanai nav plaša pielietojuma, jo tajā no sarežģītāka savienojuma iegūst vienkāršāku.
5. Oksidēšana
Oksidējot alkēnus ar kālija permanganātu vāji sārmainā vidē, iegūst divvērtīgos spirtus:
![]()
Alkēni, it sevišķi gāzveida un viegli gaistošie alkēni, līdzīgi alkāniem deg. Alkēni deg ar viegli kūpošu liesmu, izdalot lielu enerģijas daudzumu.
![]()
6. Polimerizācija
Katalizatora klātbūtnē un paaugstinātā temperatūrā alkēnu molekulas var savienoties cita ar citu, veidojot garas virknes. Polietēna, ko parasti sauc par polietilēnu, veidošanos no etēna shematiski var attēlot šādi:
![]()
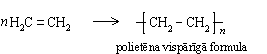
Līdzīgi etēnam polimerizējas arī propēns:
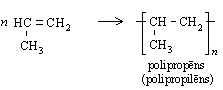
Alkēnu pierādīšana
Alkēnu divkāršās saites pierādīšanai parasti izmanto reakciju ar broma šķīdumu ūdenī vai dihlormetānā. Papildus var izmantot arī oksidēšanu ar kālija permanganāta šķīdumu, lai gan daudzi citi organiskie savienojumi šādos apstākļos arī var oksidēties. Oksidēšanu veic bāziskā vidē. Abās reakcijās novēro šķīdumu atkrāsošanos. Reakciju vienādojumus skat. iepriekš.
14. Demonstrējums. Etēna iegūšana, depolimerizējot polietilēnu
(Skat. DL Etēna iegūšana, depolimerizējot polietilēnu.)
Mērķis. Iepazīties ar etēna īpašībām, iegūstot to no polietilēna.
Audzēknim sasniedzamais rezultāts
- Prot izdarīt novērojumus un secinājumus.
- Zina etēna pierādīšanas reakcijas.
- Prot uzrakstīt reakciju vienādojumus.
Darba piederumi, vielas: nelieli polietilēna gabaliņi, koncentrēta sērskābe, bromūdens, 0,01% kālija permanganāta (KMnO4) šķīdums (vāji sārts); viena liela mēģene, 2 parastās mēģenes, gāzu novadcaurulīte, spirta lampiņa.
Darba gaita
1. Lielajā mēģenē ievieto smalki sagrieztu polietilēnu (~ ¼ no tilpuma) un pievieno 2-3 ml koncentrētas sērskābes.
2. Sagatavo mēģenes etēna pierādīšanai: vienā mēģenē ielej 1 ml bromūdens, bet otrā – 1 ml kālija permanganāta šķīduma.
3. Mēģenei, kurā atrodas polietilēns, uzliek aizbāzni ar gāzu novadcaurulīti un karsē.
4. Izdalījušos gāzi ievada mēģenē ar bromūdeni un novēro, vai šķīdums atkrāsojas. Pēc tam gāzi ievada mēģenē ar kālija permanganāta šķīdumu un bromūdeni.
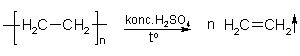
Jautājumi audzēkņu izpratnes pārbaudei
- Kāpēc šķīdumi atkrāsojās?
- Kāpēc šķīdumu atkrāsošanos nenovēro, tikko gāze sāk izdalīties?
- Ja ar kādu reaģentu nenovēroji atkrāsošanos, mini iespējamos iemeslus!
Metodiskas piezīmes
Eksperimentam piemērotāki ir bieza polietilēna gabaliņi, lai mēģenē tos varētu ievietot blīvāk. Ja polietilēna ir par maz, eksperiments neizdodas.
Eksperimentu var veikt kā pētniecisku darbu. Skolotājs veic demonstrējumu, pēc skolotāja ieskatiem izvēloties kādu no trim problēmjautājumiem:
- Ja, etēnu polimerizējot, iegūst polietilēnu, vai polimēru var sadalīt un iegūt atpakaļ etēnu?
- Polimērmateriāli parasti ir termiski neizturīgi un tos „saēd” koncentrēta sērskābe. Kā par to varētu pārliecināties praktiski?
- Kā pierādīt, vai, polietilēnam sadaloties, tiešām rodas etēns?
15. Riski un problēmas
Tehniskie šķidrumi un šķīdinātāji
No daudziem tehniskajiem šķidrumiem ikdienā sevišķi bieži sastopas ar benzīnu, petroleju, dīzeļdegvielu, bremžu eļļu. Strādājot ar šīm vielām, jāievēro piesardzība, jo tās ir toksiskas ne tikai tad, ja tās nejauši iedzer, bet arī, ja tās nokļūst uz ādas, it sevišķi uz gļotādām. Dažu šo vielu tvaiku ieelpošana var izraisīt saindēšanos.
Benzīns (ogļūdeņražu maisījums, kur C5-C10) izraisa CNS darbības traucējumus (rada narkotisko efektu), acu gļotādas un augšējo elpošanas ceļu iekaisumu. Sevišķas briesmas draud, ja benzīns nokļūst mutē un elpošanas ceļos, jo ogļūdeņraži var izraisīt ķīmisko pneimoniju. Benzīnam nokļūstot kuņģī, var notikt smaga saindēšanās jau ar 20 – 50 ml devu. Etilētā benzīna (pievienots 1,5 g tetraetilsvina Pb(C2H5)4 uz 1 l benzīna) toksiskā deva ir daudz mazāka.
Kaitīgo vielu - benzpirēnu rašanās pārtikas sagatavošanas procesā
Nozīmīgs pārtikas produktu piesārņojuma avots ir pārtikas sagatavošana. Ļoti bīstami ir poliaromātiskie ogļūdeņraži (PAO), kas veidojas pārtikas produktos, tos termiski apstrādājot. Īpaši augsts PAO saturs ir kūpinātos un grillētos produktos. Policikliskie savienojumi veidojas arī, pārtikas produktus grauzdējot, piemēram, kafijā. Dažādi PAO veidojas cigaretes degšanas laikā un nokļūst smēķētāja plaušās.
Pie PAO pieder benzpirēni. Šie policikliskie savienojumi veidojas no vienkāršām molekulām. Termiski sadaloties dažādiem savienojumiem, veidojas ogļūdeņražu radikāļi, kam ir augsta aktivitāte. Dažādi kombinējoties, tie veido poliaromātiskus ogļūdeņražus ar stabilu ciklisku struktūru:
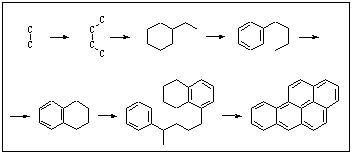
Benzpirēnu dēvē par apkārtējās vides indi. Tas rodas, sadegot naftai, atkritumiem, automobiļu degvielai, veidojas mežu ugunsgrēku laikā, ir sastopams cigarešu dūmos, kā arī ceptā gaļā. Benzpirēna toksiskās iedarbības pamatā ir kancerogēna metabolīta veidošanās, kā rezultātā DNS replikācijā rodas traucējumi un kļūdas. Šādas kļūdas rada ģenētiskā koda izmaiņas (mutācijas), kas var izraisīt vēža šūnu attīstību.
Apkārtējā vidē un pārtikā pierādīti ap 100 dažādu PAO, apmēram viena ceturtdaļa no tiem darbojas kā vēža izraisītāji. No PAO visaugstākais toksiskums piemīt benz[a]pirēnam, kura deva 5,6´10-5 mmol rada aknu bojājumus un izraisa teratogēnu iedarbību pelēm.
Svarīgākie ogļūdeņraži - organiskie šķīdinātāji un to kaitīgā iedarbība uz cilvēka organismu
|
Nosaukums |
Formula |
Virš. t., °C |
Izmantošana |
Kaitīgā iedarbība |
|
Pentāns |
C5H12 |
36 |
Šķīdinātājs |
CNS, perifērā nervu sistēma; gļotādu kairinājums, akūtas saindēšanās iespējas, narkotiska iedarbība |
|
Heksāns |
C6H14 |
69 |
Audumu sausai tīrīšanai, iekšdedzes dzinēju degvielas sastāvdaļa |
|
|
Heptāns |
C7H16 |
98 |
||
|
Toluols |
C6H5CH3 |
111 |
Sveķu, plastmasu, krāsu, laku, gumijas šķīdinātājs, piedeva degvielai |
Aknas, nieres; galvassāpes un reiboņi, līdzsvara traucējumi |
|
m-ksilols |
C6H4(CH3)2 |
139 |
Laku un krāsu šķīdinātājs, piedeva degvielai |
* nav ņemta vērā iedarbības pakāpe