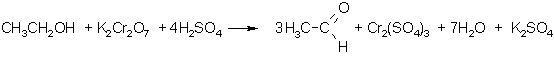Spirti
D.Cēdere. Spirti
5. Alkanolu ķīmiskās īpašības
1. Hidroksilgrupas H atoma aizvietošanās
Ar stiprām bāzēm alkanoli veido sāļus - alkoholātus. Šajā reakcijā tie reaģē kā skābes. Alkanoliem skābes īpašības izteiktas ļoti vāji. Tomēr līdzīgi ūdenim etanols reaģē ar nātriju, veidojas nātrija etilāts un izdalās ūdeņradis:
![]()
Pieaugot alkanolu molekulmasai, to skābes īpašības vēl samazinās un augstākie alkanoli nereaģē pat ar kāliju.
2. Reakcija ar halogēnūdeņražiem (-OH grupas aizvietošanās)
Alkanoliem reaģējot ar halogēnūdeņražiem, rodas halogēnalkāni:
![]()
No etanola var iegūt etēnu. Paaugstinātā temperatūrā koncentrētas sērskābes klātienē no etanola molekulas atšķeļas ūdens. Veidojas C=C divkāršā saite un rodas etēns:
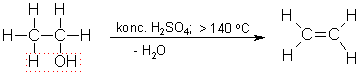
Ja reakcijas maisījuma temperatūra ir zemāka par 140 °C, tad ūdens atšķelšanās notiek citādi: no katrām divām etanola molekulām atšķeļas viena ūdens molekula un veidojas dietilēteris CH3-CH2-O-CH2-CH3.
4. Alkanolu oksidēšana
Pirmējie alkanoli oksidējas līdz alkanāliem (aldehīdiem), kuri savukārt ļoti viegli oksidējas tālāk līdz karbonskābēm:
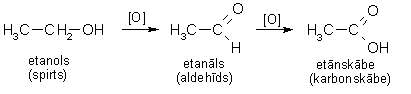
Uzmanīgi oksidējot, var izdalīt oksidēšanās starpproduktu - alkanālu. Reakcijas gaitā to atdestilē, tā pasargājot no tālākas oksidēšanās. Par oksidētāju visbiežāk lieto kālija dihromāta un sērskābes maisījumu. Oksidējot etanolu, var iegūt etanālu (acetaldehīdu):