Spirti
| Site: | Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu kompetences paaugstināšana |
| Course: | ĶīmiT026 : Mūsdienīgs un atvērts mācību process ķīmijā profesionālajā izglītībā |
| Book: | Spirti |
| Printed by: | Guest user |
| Date: | Tuesday, 10 March 2026, 4:48 AM |
Description
D.Cēdere. Spirti
1. Titullapa



D.Cēdere
Spirti
Materiāls izstrādāts
ESF Darbības programmas 2007. - 2013.gadam „Cilvēkresursi un nodarbinātība”
prioritātes 1.2. „Izglītība un prasmes”
pasākuma 1.2.1.„Profesionālās izglītības un vispārējo prasmju attīstība”
aktivitātes 1.2.1.2. „Vispārējo zināšanu un prasmju uzlabošana”
apakšaktivitātes 1.2.1.1.2. „Profesionālajā izglītībā iesaistīto pedagogu
kompetences paaugstināšana”
Latvijas Universitātes realizētā projekta
„Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu
kompetences paaugstināšana”
(Vienošanās Nr.2009/0274/1DP/1.2.1.1.2/09/IPIA/VIAA/003,
LU reģistrācijas Nr.ESS2009/88) īstenošanai.
Rīga, 2010
2. Ievads
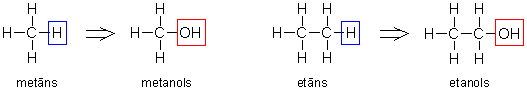
Spirti ir atvasināti no ogļūdeņražiem, to molekulās ūdeņraža atoms ir aizstāts ar OH-grupu:
Sagaidāmais rezultāts
- Zina jēdzienus: spirti, vienvērtīgi spirti, daudzvērtīgi spirti, alkanoli.
- Izprot spirtu uzbūvi. Sastāda izomēru formulas konkrētam savienojumam no alkanolu homologu rindas.
- Uzraksta spirtu homologus pēc vispārīgās formulas, nosauc spirtus atbilstoši IUPAC nomenklatūras prasībām.
- Izprot spirtu oksidēšanās, aizvietošanas, rūgšanas reakcijas.
- Raksta reakciju vienādojumus homologu rindu vispārīgajam loceklim, kas raksturo vienvērtīgos un daudzvērtīgos spirtus.
- Ķīmijas laboratorijā pazīst etilspirtu un glicerīnu pēc fizikālajām īpašībām un to raksturīgajām reakcijām.
- Zina spirtu nozīmi sadzīvē un izvēlētajā profesijā.
Metodiski ieteikumi skolotājiem
Spirti ir izplatīti dabā, dažus no tiem plaši izmanto sadzīvē un tehnikā. Visvairāk lietotais ir etanols (etilspirts), kurš ietilpst dažādu alkoholisko dzērienu sastāvā, tiek lietots medicīnā lokālai dezinficēšanai, biodegvielas ieguvei. Etanols ir arī labs šķīdinātājs. Speciālistiem, kuriem jāstrādā ar etanolu, jāzina, kā nesajaukt to ar indīgo metanolu. Pārtikā un parfimērijā izmanto glicerīnu, kuru nedrīkst sajaukt ar otru bieži lietoto daudzvērtīgo spirtu etilēnglikolu, kurš ir toksisks.
Ar spirtiem nākas saskarties dažādu profesiju pārstāvjiem – pavāriem, konditoriem, kosmetologiem, mediķiem un smalkmehāniķiem, kā arī tiem, kuri par degvielu lietos bioetanolu.
Šī temata apguvē vienlīdz svarīgas ir fizikālās un ķīmiskās īpašības, tāpēc, sākot mācīties par spirtiem, ir nepieciešami biežāk izmantojamo spirtu – etanola, etilēnglikola un glicerīna paraugi, lai iepazītos ar šo ārējām pazīmēm - krāsu, smaržu, viskozitāti. Apgūt tematu palīdzēs praktiska iepazīšanās ar šo spirtu fizikālajām īpašībām, šāds laboratorijas darbs ir vienkārši veicams un veido zināšanas un prasmes, kas nepieciešamas daudzās profesijās.
Zināšanu nostiprināšanai par spirtu molekulu uzbūvi, homologu rindu un viršanas un kušanas temperatūru likumsakarīgu izmaiņu homologu rindā paredzēts patstāvīgais darbs DL Alkanolu molekulu uzbūve un homologu rinda.
Ar spirtiem ir veicami vienkārši eksperimenti, kas palīdz labāk izprast spirtu molekulu uzbūvi un -OH grupas lomu šķīšanas procesā, šķīdinot spirtus dažāda veida šķīdinātājos - polārajā (ūdens) un nepolārajā (benzīns). Tieši ar vielu fizikālajām īpašībām praksē nākas sastapties it bieži. Skat. pamatdemonstrējumus "Spirtu īpašības" un DL Spirtu īpašības. Tālāk ir ievietoti divi demonstrējumi izziņas intereses veicināšanai, kurus skolotāji var izmantot pēc saviem ieskatiem (8.2.nodaļa.Saistošie eksperimenti).
Prezentācijā PP Spirti ievietota apkopojoša informācija, kas saistīta galvenokārt ar svarīgāko spirtu īpašībām un izmantošanu. Tajā ievietots arī pārskats par etilspirta ražošanu un ietekmi uz cilvēka organismu.
Tests alkohola līmeņa noteikšanai organismā.
3. Alkanolu molekulu uzbūve un nosaukumi
A
Alkanoli ir alkānu hidroksilatvasinājumi, tie ir vienkāršākie spirti. To molekulās ir viena hidroksilgrupa. Vienkāršākais alkanolu pārstāvis ir metanols jeb metilspirts.
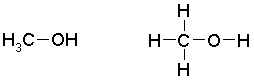
Metanola molekulas uzbūve.
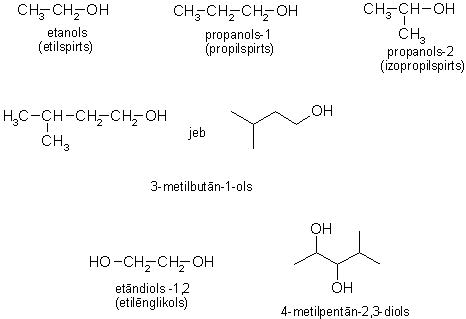
Alkanolu nosaukumus atvasina no alkānu nosaukumiem ar izskaņu -ols, norādot, pie kura oglekļa atoma atrodas -OH grupa. Galveno virkni numurē no tā gala, kuram tuvāk atrodas hidroksilgrupa. Atsevišķiem savienojumiem lieto arī triviālos nosaukumus.
4. Alkanolu fizikālās īpašības
Zemākie alkanoli (līdz C12) istabas temperatūrā ir bezkrāsaini šķidrumi, tālākie alkanoli ir bezkrāsainas, cietas vielas. To blīvums ir mazāks par 1 g/ml.
Alkanolu viršanas temperatūras ir daudz augstākas nekā alkāniem ar tādu pašu molekulmasu. Paaugstināto viršanas temperatūru cēlonis ir saites O-H polaritāte. Tā rezultātā starp alkanola molekulām veidojas ūdeņraža saites un norisinās šo molekulu asociācija. Starpmolekulārās ūdeņraža saites var konstatēt spektroskopiski un ar rentgenstruktūranalīzi. Attālums starp blakusesošo molekulu skābekļa atomiem ir aptuveni 0,28 nm. Ja pieņemtu, ka asociācija nenorisinās, tad šim attālumam būtu jābūt lielākam (0,35 nm):
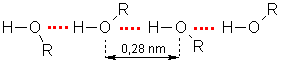
Šķidrumam iztvaikojot, ūdeņraža saites starp molekulām pārtrūkst. Šim procesam jāpatērē papildu enerģija, tāpēc arī viršana notiek augstākā temperatūrā nekā alkāniem.Homologu rindā, pieaugot molekulmasai, alkanolu viršanas temperatūras paaugstinās līdzīgi kā alkāniem. Alkanoliem ar sazarotu oglekļa atomu virkni viršanas temperatūras ir zemākas nekā alkanoliem ar nesazarotu virkni.
Alkanolu molekulas var veidot ūdeņraža saites ne tikai savā starpā, bet arī ar ūdens molekulām:
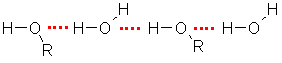
Tāpēc zemākie alkanoli labi šķīst ūdenī. Metanols un etanols sajaucas ar ūdeni jebkurās attiecībās. Spirta molekulu nosacīti var sadalīt divās daļās. Ogļūdeņraža atlikums (alkilgrupa) ir hidrofobā daļa, bet hidroksilgrupa - hidrofilā daļa. Ūdeņraža saišu veidošanos ar ūdens molekulām un tātad arī šķīdību ūdenī nodrošina hidroksilgrupa. Palielinoties ogļūdeņraža atlikumam, spirta šķīdība ūdenī samazinās:
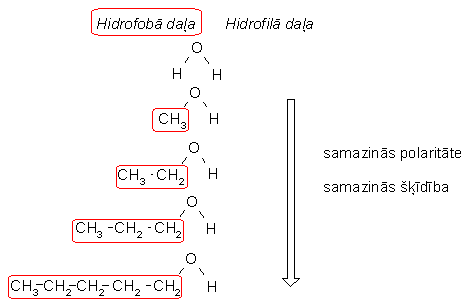
Alkanoli ir labi šķīdinātāji. Polārās -OH grupas dēļ alkanolos šķīst polāras vielas, bet nepolārais ogļūdeņraža atlikums nodrošina nepolāru vielu šķīdību. Tāpēc, piemēram, etanolā šķīst gan ūdens, gan benzols.
5. Alkanolu ķīmiskās īpašības
1. Hidroksilgrupas H atoma aizvietošanās
Ar stiprām bāzēm alkanoli veido sāļus - alkoholātus. Šajā reakcijā tie reaģē kā skābes. Alkanoliem skābes īpašības izteiktas ļoti vāji. Tomēr līdzīgi ūdenim etanols reaģē ar nātriju, veidojas nātrija etilāts un izdalās ūdeņradis:
![]()
Pieaugot alkanolu molekulmasai, to skābes īpašības vēl samazinās un augstākie alkanoli nereaģē pat ar kāliju.
2. Reakcija ar halogēnūdeņražiem (-OH grupas aizvietošanās)
Alkanoliem reaģējot ar halogēnūdeņražiem, rodas halogēnalkāni:
![]()
No etanola var iegūt etēnu. Paaugstinātā temperatūrā koncentrētas sērskābes klātienē no etanola molekulas atšķeļas ūdens. Veidojas C=C divkāršā saite un rodas etēns:
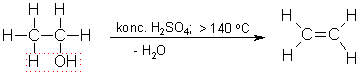
Ja reakcijas maisījuma temperatūra ir zemāka par 140 °C, tad ūdens atšķelšanās notiek citādi: no katrām divām etanola molekulām atšķeļas viena ūdens molekula un veidojas dietilēteris CH3-CH2-O-CH2-CH3.
4. Alkanolu oksidēšana
Pirmējie alkanoli oksidējas līdz alkanāliem (aldehīdiem), kuri savukārt ļoti viegli oksidējas tālāk līdz karbonskābēm:
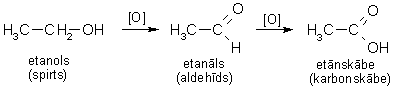
Uzmanīgi oksidējot, var izdalīt oksidēšanās starpproduktu - alkanālu. Reakcijas gaitā to atdestilē, tā pasargājot no tālākas oksidēšanās. Par oksidētāju visbiežāk lieto kālija dihromāta un sērskābes maisījumu. Oksidējot etanolu, var iegūt etanālu (acetaldehīdu):
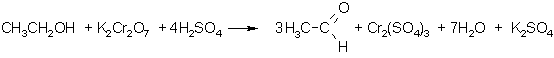
6. Svarīgākie alkanolu pārstāvji
Metanols (metilspirts, koka spirts) CH3OH
Metanols ir bezkrāsains šķidrums (viršanas temperatūra 65 °C) ar specifisku smaržu, kas līdzīga etanola smaržai. Ar ūdeni sajaucas jebkurās attiecībās. Agrāk metanolu ieguva tikai no koksnes. No tā arī cēlies nosaukums ²koka spirts². Metanols ir inde (organismam kaitīgs ir nevis pats metanols, bet gan tā bioķīmisko pārvērtību produkti metānskābe un metanāls). Pat nelieli metanola daudzumi (6 - 10 ml) var izraisīt aklumu, bet 25 - 30 ml deva var būt jau nāvējoša. Diemžēl saindēšanās pazīmes parādās tikai pēc 15 - 20 stundām, kad medicīniskās palīdzības sniegšana jau ir nokavēta.
Etanols (etilspirts, vīna spirts) C2H5OH
Etanolu bieži sauc vienkārši par spirtu vai alkoholu. Etanols ir bezkrāsains šķidrums (viršanas temperatūra 78 °C) ar patīkamu smaržu,. Ar ūdeni sajaucas jebkurās attiecībās. Etanols ar ūdeni veido azeotropo maisījumu*, kas satur 95,6% etanola. To sauc par rektifikātu. Bezūdens etanolu parasti sauc par absolūto etanolu. Rūpniecības vajadzībām etanolu iegūst, hidratējot etēnu. Etanolu alkoholisko dzērienu pagatavošanai iegūst rūgšanas procesā. Etanolam piemīt dezinficējošas īpašības. Etanolam piemīt narkotiskām vielām līdzīga iedarbība.
Etān-1,2-diols (etilēnglikols) HO-CH2-CH2-OH ir šķidra viela bez krāsas un smaržas, ar saldenu garšu. Toksisks.
Propān-1,2,3-triols (glicerīns) HO‑CH2-CH2(OH)-CH2-OH ir viskozs šķidrums, ar saldu garšu. Dabā sastopams galvenokārt tauku un citu lipīdu sastāvā.
* Azeotropais maisījums ir divu vai vairāku šķidrumu viendabīgs maisījums, kas destilācijas procesā nesadalās frakcijās. Destilējot maisījuma sastāvs paliek nemainīgs. Azeotrops - no grieķu valodas vārda a (nolieguma partikula) + zeo - verdu + tropē - maiņa.
7. Dietilēteris
Ēteru vispārīgā formula:
![]()
Dietilēteris, ko sadzīvē sauc vienkārši par ēteri, ir biežāk lietotais ēteru pārstāvis.
Tas ir bezkrāsains, viegli gaistošs šķidrums, kura viršanas temperatūra 35 °C. Dietilēteris ir neitrāls savienojums un samērā inerts, taču viegli reaģē ar skābekli, veidojot peroksīdus. Peroksīdi ir termiski nestabili savienojumi. Ēteris viegli uzliesmo, un šī reakcija var notikt ar sprādzienu.
Dietilēteris ir labs šķīdinātājs, tomēr tā izmantošana lielākos apmēros ir ierobežota ugunsnedrošības dēļ. Dietilētera tvaikiem ir narkotiska iedarbība. Dietilēteri jāuzglabā cieši noslēgtā tumša stikla traukā, vēsā vietā, lai novērstu iespējamu peroksīdu veidošanos.
8. Demonstrējumi
Temata apguvei ieteicami skolotāja demonstrējumi, kurus audzēkņi vēro un aizpilda darba lapas. Papildus ir doti divi saistošie eksperimenti.8.1. Pamatdemonstrējumi. Spirtu īpašības
(Skat. DL Spirtu īpašības)
1. Ūdens pierādīšana etilspirtā
Reaģenti un materiāli: etilspirts, b/ū CuSO4, mēģene.
Darba gaita
Mēģenē ielej nedaudz etilspirta un pievieno iepriekš izkarsētu b/ū CuSO4. Ūdens klātienē veidojas zils kristālhidrāts (CuSO4×5H2O).
Metodiskas piezīmes
Etilspirts ir higroskopisks, tas viegli uzsūc mitrumu no gaisa. Pārdošanā parasti ir 96% etilspirts. Ja nepieciešams bezūdens etilspirts, parastais etilspirts ir jāapstrādā ar spēcīgiem dehidratējošiem reaģentiem un iegūtais produkts jāglabā hermētiski noslēgtā traukā.
2. Spirtu ūdens šķīdumu vides pH pārbaude
Reaģenti un materiāli: etilspirts, ūdens; mēģene, indikators.
Darba gaita
Mēģenē ielej 1 ml etilspirta un atšķaida ar dažiem ml ūdens. Ar indikatoru pārliecinās, ka vides reakcija ir neitrāla.
Metodiskas piezīmes
Labāk, ja var pārbaudīt vairākus spirtus.
Eksperiments uzskatāmi parāda atšķirību starp hidroksīdgrupu metālu hidroksīdos un hidroksilgrupu spirtos. Var secināt, ka spirtu hidroksilgrupa ūdens šķīdumā neatšķeļas.
3. Etilspirta oksidēšana ar CuO
Reaģenti un materiāli: etilspirts, vara stieplīte; mēģene, spirta lampiņa.
Darba gaita
Mēģenē ielej nedaudz etilspirta un tajā iegremdē izkarsētu (vēl karstu) vara stieplīti (tā ir pārklāta ar melno CuO). Karstā stieplīte spirta tvaikos reducējas, veidojot spožu metālu. Var sajust oksidēšanās produkta acetaldehīda (etanāla) smaržu.
![]()
4. Glicerīna šķīdība
Reaģenti un materiāli: glicerīns, benzīns, ūdens; 2 mēģenes.
Darba gaita
Vienā mēģenē ielej 1-2 ml ūdens, otrā 1-2 ml benzīna. Pielej 1 ml glicerīna un spēcīgi saskalina. Glicerīns šķīst ūdenī jebkurās attiecībās, benzīnā nešķīst.
Metodiskas piezīmes
Glicerīna labo šķīdību ūdenī var izskaidrot ar relatīvi lielo polāro molekulas daļu.
Ja pie glicerīna uzmanīgi pievieno ūdeni, tad sākumā veidojas divi slāņi, jo glicerīns ir blīvāks, viskozāks (d=1,3).
8.2. Saistošie eksperimenti
Spirta pierādīšana alkoholiskajos dzērienos
Reaģenti un materiāli: etilspirts; koniskā kolba, vārķermeņi, aizbāznis, 50-100 cm gara stikla caurule, spirta lampiņa vai elektriskā plītiņa.
Darba gaita
Koniskajā kolbā ielej 100 ml etilspirtu saturošu šķidrumu un dažus vārķermeņus. Kolbai uzliek aizbāzni, kurā iestiprināta taisna, gara (50-100 cm) stikla caurule. Kolbu karsē, kamēr šķidrums sāk vārīties. Kad tvaiki sasnieguši caurules augšējo galu, tos aizdedzina.
Metodiskas piezīmes
Vāroties veidojas etilspirta tvaiki un ūdens tvaiki. Ūdens, kuram ir augstāka viršanas temperatūra, sākumā kondensējas, tāpēc vispirms caurules augšējo galu sasniedz spirta tvaiki, un tos var aizdedzināt.
Borskābes etilesteris
Reaģenti un materiāli: etilspirts, boraks vai borskābe, koncentrēta sērskābe; porcelāna bļodiņa.
Darba gaita
Porcelāna bļodiņā pie dažiem mililitriem etilspirta pievieno tikpat mililitrus koncentrētas sērskābes un uzmanīgi saskalina. Pievieno „skalpeļa galu” boraka. Aizdedzina un novēro zaļu liesmas krāsu (liesmu ar zaļām malām).
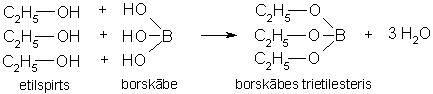
Metodiskas piezīmes
Šis ir saistošais eksperiments, to ieteicams rādīt aptumšotā telpā.
Ja degšanas reakcija neizdodas, tad iespējams, ka spirts satur pārāk daudz ūdens vai sērskābe nav koncentrēta.
Boraka vietā var ņemt borskābi.