10. klase
| Site: | Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu kompetences paaugstināšana |
| Course: | ĶīmiT026 : Mūsdienīgs un atvērts mācību process ķīmijā profesionālajā izglītībā |
| Book: | 10. klase |
| Printed by: | Guest user |
| Date: | Tuesday, 3 March 2026, 12:29 PM |
Description
10. klase
Titullapa



Jurijs Kuklis
10. Klase
Materiāls izstrādāts
ESF Darbības programmas 2007. - 2013.gadam „Cilvēkresursi un nodarbinātība”
prioritātes 1.2. „Izglītība un prasmes”
pasākuma 1.2.1.„Profesionālās izglītības un vispārējo prasmju attīstība”
aktivitātes 1.2.1.2. „Vispārējo zināšanu un prasmju uzlabošana”
apakšaktivitātes 1.2.1.1.2. „Profesionālajā izglītībā iesaistīto pedagogu
kompetences paaugstināšana”
Latvijas Universitātes realizētā projekta
„Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu
kompetences paaugstināšana”
(Vienošanās Nr.2009/0274/1DP/1.2.1.1.2/09/IPIA/VIAA/003,
LU reģistrācijas Nr.ESS2009/88) īstenošanai.
Rīga, 2010
Pētnieciskā darbība ķīmijā
Temats: Pētnieciskā darbība ķīmijā.
1. Izlasi apgalvojumu un atzīmē jā, ja apgalvojums ir patiess un nē, ja apgalvojums ir kļūdains. Atbildi pieraksti blakus apgalvojuma numuram ierakstot jā vai nē.
|
Nr. |
Apgalvojums |
jā/nē |
|
1. |
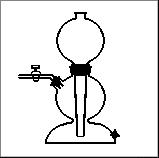
Kipa aparātu izmanto ūdens sadalīšanai. |
|
|
2. |
Strādājot ar kairinošām vielām, jāizmanto gumijas cimdi. |
|
|
3. |
Bioķīmija pēta ķīmiskos procesus, kuri noris dzīvajos organismos. |
|
|
4. |
Ja, sadedzinot 48 gramus tīra oglekļa tiek patērēts 89,6 litri skābekļa, tad veidosies 4 moli oglekļa (IV) oksīda. |
|
|
5. |
Zīmi |
|
Vieta atbildēm:
|
Apgalvojuma Nr. |
Atbildes variants jā/nē |
|
1. |
nē |
|
2. |
nē |
|
3. |
jā |
|
4. |
jā |
|
5. |
jā |
2.Izvēlies vienu, pareizu atbildes variantu, no piedāvātajiem. Atbildi pieraksti, jautājuma numuram pievienojot atbildes burtu.
|
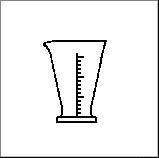
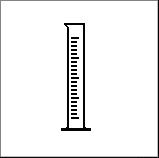
1. Kuru no piedāvātajiem traukiem lietderīgāk izmantot lai precīzi nomērītu 22 ml destilētā ūdens? |
|||
|
a. |
b. |
c. |
d. |
|
2. Kurš no zinātniekiem XIX gada beigās, XX gadsimta sākumā strādājis Rīgā 1913., 1914. un 1934.gados tika izvirzīts, kā kandidāts Nobeļa prēmijai? |
|||
|
a. V.Ostvalds |
b. P.Valdens |
c. D.H.Grindelis |
d. S.Areniuss |
|
3. Kurā no pētnieciskā darba posmiem pētnieks atbild uz jautājumu - ko es redzu? |
|||
|
a. Novērojumi |
b. Hipotēze |
c. Darba gaita |
d. Secinājums |
|
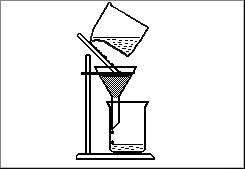
4. Kura no vielu attīrīšanas metodēm atspoguļota zīmējumā? |
|||
|
a. filtrēšana |
b. destilēšana |
c. iztvaicēšana |
d. nostadināšana |
|
5. Cik grādiem pēc Kelvina skalas atbilst tīrā ūdens viršanas temperatūra? |
|||
|
a. 0 |
b. 100 |
c. 273 |
d. 373 |
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants |
|
1. |
c |
|
2. |
b |
|
3. |
c |
|
4. |
a |
|
5. |
d |
3. Izmantojot piedāvātos atslēgas vārdus, uzraksti pareizu tekstu par ķīmijas tematu. Atbildi pieraksti, izveidojot ciparu un atslēgas vārdu burtu virkni (piemēram, 1a,2e, un t.t).
Atslēgas vārdi: a. Bioķīmija, b. Ģeoķīmija, c. Analīze, d. Agroķīmija, e.Sintēze f. Fizikāla ķīmija.
Ķīmija pēta vielas. Vielu pētīšanai tiek izmantoti vairāki dažādi paņēmieni. Piemēram, nosakot vielas sastāvu, var izmantot 1___ - kad vielas sastāvu nosaka, sadalot to sastāvdaļās un 2___, kad sarežģītāku savienojumu iegūst no vienkāršākām vielām. Pēc pētīšanas objektiem ķīmiju iedala nozarēs. Tā 3___ pēta ķīmiskās reakcijas dzīvajos organismos, bet 4____ pēta augu barošanas procesus un iespēju paaugstināt ražu un augu aizsardzību, izmantojot ķīmiskos līdzekļus. Dažādu zinātņu „simbioze” kļuva savulaik par ķīmijas apakšnozaru pamatu. Piemēram, zemes ķīmisko sastāvu un dabā atrodamos minerālus un rūdas pēta 5___, bet 6___ pēta vielu uzbūvi un ķīmisko reakciju likumsakarības.
Atbilde: 1c,2e,3a,4d,5b,6f.
4. No piedāvātajiem atbilžu variantiem izvēlies vienu vai vairākus pareizos atbilžu variantus. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu vai burtu virkni.
|
1. Kuros no nosauktajiem uzņēmumiem Latvijā ražo medikamentus? |
|||
|
a. Grindeks AS |
b. SIA AEROC |
c. Dzintars AS |
d. Olainfarm AS |
|
2. Kāda ir 5 kmolu ūdens masa? |
|||
|
a. 90 g |
b. 90 000 g |
c. 90 kg |
d. 90 000 mg |
|
3. Kāda temperatūra un spiediens atbilst pieņēmumam - normāli apstākļi? |
|||
|
a. 0 oC un 1 atmosfēra |
b. 25 oC un 760 mm Hg staba |
c. 0 oC un apmēram 100 Pa |
d. 273 K un 101 325 Pa |
|
4. Kāda ir vielas blīvuma mērvienība? |
|||
|
a. g |
b. cm3 |
c. g/cm3 |
d. cm3/g |
|
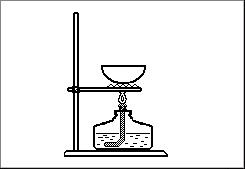
5. Kura no eksperimentālā darba metodēm atspoguļota zīmējumā? |
|||
|
a. destilēšana |
b. iztvaicēšana |
c. filtrēšana |
d. ietvaicēšana |
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants/-i |
|
1. |
a,d |
|
2. |
b,c |
|
3. |
a,d |
|
4. |
c |
|
5. |
b,d |
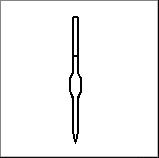
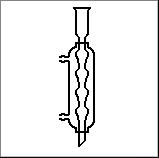
5. Katram no uzzīmētajiem traukiem vai piederumiem piemeklē atbilstošo nosaukumu un izmantošanu. Atbildi pieraksti blakus zīmējuma numuram, pievienojot nosaukuma burtu un izmantošanas burtu.
|
Ķīmisko trauku un piederumu zīmējumi |
|
Nosaukumi |
|
1.
|
A Areometrs |
|
|
2. |
B Kipa aparāts |
|
|
3.
|
C Tīģelis |
|
|
4. |
D Mērcilindrs |
|
|
5. |
E Dzesinātājs |
|
|
|
F Pipete |
|
|
Trauka vai piederuma izmantošanas īss apraksts |
||
|
a. Izmanto gāzveida vielu iegūšanai cietu vielu reakcijās ar šķīdumiem. Piemēram, kalcija karbonātam reaģējot ar sālsskābi, iegūst ogļskābo gāzi. |
||
|
b. Lieto destilācijas iekārtās. Pa apvalku no apakšas uz augšu plūst aukstais ūdens, bet kondensējamie tvaiki plūst pa centrālo cauruli no augšas uz leju.. |
||
|
c. Ierīci lieto šķidru vielu blīvuma noteikšanai. |
||
|
d. Izmanto vielu karsēšanai, sakausēšanai. Izgatavo no metāla vai porcelāna. |
||
|
e. Izmanto šķīdumu (šķidrumu) tilpuma mērīšanai. Visbiežāk lieto traukus ar precīzu tilpumu, piemēram, 10, 20 vai 50 mililitri. |
||
Vieta atbildēm:
|
Ķīmiska trauka vai piederuma zīmējuma Nr. |
Nosaukuma un izmantošanas burti |
|
1. |
Ba |
|
2. |
Ac |
|
3. |
Fe |
|
4. |
Eb |
|
5. |
Cd |
Dispersās sistēmas
Temats: Dispersās sistēmas.
1. Izlasi apgalvojumu un atzīmē jā, ja apgalvojums ir patiess un nē, ja apgalvojums ir kļūdains. Atbildi pieraksti blakus apgalvojuma numuram, ierakstot jā vai nē.
|
Nr. |
Apgalvojums |
jā/nē |
|
1. |
Emulsija ir dispersā sistēma, kur viena šķidruma daļiņas izkliedētas otra šķidruma vidē. |
|
|
2. |
Visas vielas siltā ūdenī šķīst labāk nekā aukstā ūdenī . |
|
|
3. |
Kristālhidrāti ir sāļi, kuros ir ķīmiski saistīts ūdens. |
|
|
4. |
Nepiesātināts šķīdums ir šķīdums, kurā viela vairāk nešķīst. |
|
|
5. |
Pagatavojot H2SO4 šķīdumu, sērskābe uzmanīgi jālej ūdenī. |
|
Vieta atbildēm:
|
Apgalvojuma Nr. |
Atbildes variants jā/nē |
|
1. |
jā |
|
2. |
nē |
|
3. |
ja |
|
4. |
nē |
|
5. |
jā |
2.Izvēlies vienu pareizu atbildes variantu no piedāvātajiem. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu.
|
1. Kāda ir kristālhidrāta formula, ja 160 grami vara (II) hidroksīda ir ķīmiski saistīti ar 90 gramiem ūdens? |
|||
|
a. CuSO4.H2O |
b. CuSO4.3H2O |
c. CuSO4.5H2O |
d. CuSO4.7 H2O |
|
2. Kādu eksperimentu izmanto, lai precizētu, vai šķīdums ir īsts, vai koloidāls? |
|||
|
a. Konstants lielums |
b. Tindāla efekts |
c. Nostādināšana |
d. Iedarbība ar magnētu |
|
3. Cilvēka saimnieciskās darbības rezultātā atmosfērā nokļūst cietas daļiņas, kas sajaucas ar gaisā esošām gāzveida vielām un ūdens tvaikiem. Šī piesārņojuma rezultātā Londonā 20. gadsimta 50.-tajos gados dzīvību zaudēja vairāki tūkstoši cilvēku. Kā sauc šo piesārņojumu? |
|||
|
a. migla |
b. putekļi |
c. aerosols |
d. smogs |
|
4. Kādu no piedāvātajām metodēm izmanto šķīduma koncentrācijas noteikšanai ar indikatora palīdzību? |
|||
|
a. gravimetrija |
b. tilpumanalīze |
c. titrēšana |
d. hromatogrāfija |
|
5. Cik liela NaOH masa ir nepieciešama, lai pagatavotu 500 mililitrus 0,2 M šķīduma? |
|||
|
a. 4 g |
b. 40 g |
c. 2g |
d. 0,1 mol |
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants |
|
1. |
c |
|
2. |
b |
|
3. |
d |
|
4. |
c |
|
5. |
a |
3. Izmantojot piedāvātos atslēgas vārdus, uzraksti pareizu tekstu par ķīmijas tematu. Atbildi pieraksti, izveidojot ciparu un atslēgas vārdu burtu virkni (piemēram, 1a,2e, un t.t).
Atslēgas vārdi: a. _w_, b. Šķīdums, c. Masas daļa, d. Molārā koncentrācija, e._c_, f. Masas koncentrācija, g. Izšķīdināta viela, h. Koncentrācija.
Kā zināms, šķīdumi sastāv no 1_____ kura ir izšķīdināta 2___. Taču, lai izteiktu cik izšķīdinātas vielas ir šķīdumā, izmanto dažādus paņēmienus. Piemēram, izšķīdinātās vielas masas attiecība pret šķīduma masu ir 3___ un to apzīmē 4___. Biežāk, lai skaitļi nebūtu ļoti mazi, tos izsaka %, reizinot rezultātu ar 100%. Ja vēlas izteikt, cik vielas ir šķīduma tilpumā, izmanto jēdzienu 5___. Piemēram, izšķīdinātās vielas daudzuma (mol) attiecība pret šķīduma tilpumu (l) ir 6___ un to apzīmē 7___. Praksē izmanto arī citas šķīduma koncentrācijas, piemēram, izšķīdinātas vielas masas attiecība pret šķīduma tilpumu ir 8___.
Atbilde: 1g,2b,3c, 4a,5h,6d,7e,8f.
4. No piedāvātajiem atbilžu variantiem izvēlies vienu vai vairākus pareizos atbilžu variantus. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu vai burtu virkni.
|
1.Kurās dispersās sistēmās gāzveida fāze ir šķidrā vidē? |
|||
|
a. aerosols |
b. gāzēts ūdens |
c. migla |
d. suspensija |
|
2. Kurās dispersās sistēmās šķidrā fāze un gāzveida vidē? |
|||
|
a. aerosols |
b. gāzēts ūdens |
c. migla |
d. suspensija |
|
3. Cik lielas KOH un ūdens masas nepieciešamās KOH šķīduma pagatavošanai ar izšķīdinātās vielas w% = 15%. |
|||
|
a. 15 g KOH, 85 g ūdens |
b. 15 g KOH, 100 g ūdens |
c. 30 g KOH, 100 g ūdens |
d. 30 g KOH, 170 g ūdens |
|
4. Kā sauc vielu, kuras formula ir Na2CO3.10H2O? |
|||
|
a. nātrija karbonāts |
b. kristāliskā soda |
c. nātrija karbonāta dekahidrāts |
d. kristālhidrāts |
|
5. Eksperimentāli skolēns ieguva sekojošus datus par vielas masu: 10,25 g, 10,27 g, 10,23 g, 9,34 g. Kāds ir šo datu vidējais aritmētiskais? |
|||
|
a. 10,0225 |
b.10,02 |
c. 10,23 |
d. 10,25 |
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants/-i |
|
1. |
b |
|
2. |
a, c |
|
3. |
a,d |
|
4. |
b,c |
|
5. |
d |
5. Pēc dotajiem datiem par šķīduma sastāvu nosaki, vai šķīdums ir piesātināts, nepiesātināts vai pārsātināts. Atbildi pieraksti ar atbilstošu burtu.
UZMANĪBU! Uzdevuma risināšanai nepieciešams izmantot šķīdības līknes.
|
Šķīduma sastāvs |
|
Šķīduma raksturojums |
|
1. 110 g KNO3 izšķīdināti 100 g ūdens 60 oC |
A piesātināts šķīdums |
|
|
2.110 g Pb(NO3)2izšķīdināti 200 g ūdens 80oC. |
B nepiesātināts šķīdums |
|
|
3. 40 g Pb(NO3)2izšķīdināti 50g ūdens 30oC. |
C pārsātināts šķīdums |
|
|
4. 90 g KNO3 izšķīdināti 100 g ūdens 50 oC. |
|
|
|
5. 22 g NH4Cl izšķīdināti 50 g ūdens 40 oC. |
||
|
6. 65 g NH4Cl izšķīdināti 130 g ūdens 60 oC. |
|
Vieta atbildēm:
|
Šķīduma sastāva Nr. |
Šķīduma raksturojumaburts |
|
1. |
A |
|
2. |
B |
|
3. |
C |
|
4. |
C |
|
5. |
A |
|
6. |
B |
Atomu un vielu uzbūve
Temats: Atomu un vielu uzbūve.
1. Izlasi apgalvojumu un atzīmē jā, ja apgalvojums ir patiess un nē, ja apgalvojums ir kļūdains. Atbildi pieraksti blakus apgalvojuma numuram, ierakstot jā vai nē.
|
Nr. |
Apgalvojums |
jā/nē |
|
1. |
Izotopi ir viena ķīmiska elementa atomi ar atšķirīgu neitronu skaitu atoma kodolā. |
|
|
2. |
Savienojumā K2S pastāv kovalentā nepolārā saite. |
|
|
3. |
Na atoma elektronu apvalka ārējā enerģijas līmenī ir viens elektrons. |
|
|
4. |
Urāna atoma izotopā 92238U ir 92 protoni un 146 neitroni. |
|
|
5. |
Kovalento saiti veido kopējais elektronu pāris. |
|
Vieta atbildēm:
|
Apgalvojuma Nr. |
Atbildes variants jā/nē |
|
1. |
jā |
|
2. |
nē |
|
3. |
jā |
|
4. |
jā |
|
5. |
jā |
2.Izvēlies vienu, pareizo atbildes variantu no piedāvātajiem. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu.
|
1. Kāds ir maksimālais elektronu skaits p orbitālie (p apakšlīmenī) |
|||||
|
a. 2 |
b. 4 |
c. 6 |
d. 8 |
||
|
2. Kāda daļiņa tiek izsviesta no atoma kodola alfa-starojuma rezultātā? |
|||||
|
a. elektrons |
b. hēlija atoma kodols |
c. protons |
d. neitrons |
||
|
3. Kurš no zinātniekiem 1897. eksperimentāli pierādīja elektronu? |
|||||
|
a. D.D.Tomsons |
b. E.Rezerfords |
c. D.Čedviks |
d. M.Kiri |
||
|
4. Kuru kristālrežģu veidu raksturo vielas īpašības: šķīst ūdenī, kristāliskā veidā ir trausls, šķīdumi labi vada elektrību? |
|||||
|
a. atomu kristālrežģis |
b. metāliskais kristālrežģis |
c. molekulārais kristālrežģis |
d. jonu kristālrežģis |
||
|
5. Kāda ir s elektronu orbitāles forma? |
|||||
|
a. lodveida |
b. hanteļveida |
c. āboliņa lapas forma |
|||
| |
|
|
|
|
|
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants |
|
1. |
c |
|
2. |
b |
|
3. |
a |
|
4. |
d |
|
5. |
a |
3. Izmantojot piedāvātos atslēgas vārdus, uzraksti pareizu tekstu par ķīmijas tematu. Atbildi pieraksti, izveidojot ciparu un atslēgas vārdu burtu virkni (piemēram, 1a,2e, un t.t). Iegaumē, ka vienu atslēgas vārdu var izmantot vairākas reizes.
Atslēgas vārdi: a. Kodols, b.Protons, c.Elektrons, d. Enerģijas apakšlīmenis, e. Elektronu orbitāle, f.Neitrons, g. Lādiņš, h. Enerģijas līmenis.
Šodien mēs zinām, ka kādreiz nosauktais nedalāmais atoms pēc savas uzbūves ir ļoti sarežģīts. Raksturojot to ir jāatceras, ka atoma centrā ir 1__, kas aizņem ~ 1/100 000 daļu no kopējas atoma telpas. Tam ir pozitīvs 2___ kuru nosaka kodolā esošie 3___. Neraugoties uz niecīgiem izmēriem, kodolā ir koncentrēta praktiski visa atoma masa. To veido pozitīvi lādēti 4___ un neitrālie 5___. Apkārt kodolam atoma telpā ar milzīgu ātrumu pārvietojas 6___. Elektroni pārvietojas pa noteikto telpas daļu, ko sauc par 7___. Pēc enerģijas daudzuma elektronus sadala 8___, bet tos savukārt 9___.
Atbilde: 1a,2g,3b,4b,5f,6c,7e,8h,9d.
4. No piedāvātajiem izvēlies vienu vai vairākus pareizu atbilžu variantus. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu vai burtu virkni.
|
1. Kurā pierakstā, X vietā ievietojot simbolu H, pareizi tiks atspoguļota informāciju par ūdeņraža atomu izotopiem? |
|||
|
a. 11X, 12X,13X |
b. 11X, 22X33X |
c. 11X, 21X,31X |
d. X+, X2+,X3+ |
|
2. Kuras no daļiņām ir atoma kodola sastāvā? |
|||
|
a. elektrons |
b. protons |
c. neitrons |
d. pozitrons |
|
3. Augu un dzīvnieku dzīves gaitā izotopa C-14 daļa ir nemainīga. Pēc nāves C-14 sabrūk. Tā pussabrukšanas periods ir 5 730 gadi. Kāds ir dzīvnieku atlikumu fosiliju vecums, ja noteikts, ka sabruka 75% no sākotnējā C-14? |
|||
|
a. 5 730 gadi |
b. 4 297 gadi |
c. 7 640 gadi |
d. 22 920 gadi |
|
4. Kuru daļiņu sastāvā ir 18 elektroni? |
|||
|
a. Ar |
b. Cl- |
c.K+ |
d.S |
|
5. Kādam ķīmiskajam formulām atbilst modelis |
|||
|
a. H2O |
b. KOH |
c. K2SO4 |
d. HClO |
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants/-i |
|
1. |
a |
|
2. |
b,c |
|
3. |
d |
|
4. |
a,b,c |
|
5. |
b,d |
5. Katrai no piedāvātajām formulām dotas elementu elektronegativitātes (pēc L.K.Polinga). Nosauc savienojumam atbilstošo ķīmiskas saites veidu, pareizu vielas formulu un nosaukumu atbilstoši IUPAC nomenklatūrai. Atbildi pieraksti blakus elementu elektronegativitātes numuram, pievienojot ķīmiskajai saitei atbilstošo lielo burtu, formulas romiešu ciparu un nosaukuma mazo burtu (piemēram: 1. - A,I,c).
|
Elementu elektronegativitātes |
|
Ķīmiskās saites veids |
|
1. P (2,19) un P (2,19) |
A kovalentā polārā saite |
|
|
2. C (2,55) un H (2,20) |
B kovalentā nepolārā saite |
|
|
3. H (2,20) un Cl (3,16) |
C jonu saite |
|
|
4. Na (0,93) un S (2,58) |
|
|
|
5. Mg (1,31) un F (3,98) |
|
|
|
6. O (3,44) un O (3,44) |
|
|
|
|
||
|
Vielu formulas |
|
Vielu nosaukumi |
|
I HCl |
a metāns |
|
|
II MgF2 |
b magnija fluorīds |
|
|
III C2H4 |
c nātrija sulfīds |
|
|
IV P4 |
d kālija hidroksīds |
|
|
V CH4 |
e hlorūdeņradis |
|
|
VI Na2SO4 |
f butāns |
|
|
VII O2 |
g vara (II) hidroksīds |
|
|
VIII CuO |
h fosfors |
|
|
IX Na2S |
i skābeklis |
|
Vieta atbildēm:
|
Elementu elektronegativitātes Nr. |
Ķīmiskās saites burts, formulas romiešu cipars un nosaukuma burts |
|
1. |
B,IV,h |
|
2. |
A,V,a |
|
3. |
A,I,e |
|
4. |
C,IX,d |
|
5. |
C,II,b |
|
6. |
B,VII,i |
Kīmisko elementu periodiskā tabula
Temats: Ķīmisko elementu periodiskā tabula
1. Izlasi apgalvojumu un atzīmē jā, ja apgalvojums ir patiess un nē, ja apgalvojums ir kļūdains. Atbildi pieraksti blakus apgalvojuma numuram, ierakstot jā vai nē.
|
Nr. |
Apgalvojums |
jā/nē |
|
1. |
Periodā no kreisās uz labo pusi ķīmisko elementu metāliskās īpašības pastiprinās. |
|
|
2. |
Oksidētājs reakcijas rezultātā pievieno elektronus. |
|
|
3. |
SO3, CO2 un SiO2 ir bāziskie oksīdi. |
|
|
4. |
Ja reaģē SO3 un BaO, tad ķīmiskās reakcijas rezultātā veidojas BaSO3. |
|
|
5. |
Indikatoram „metiloranžs” skābā vidē ir sarkana krāsa. |
|
Vieta atbildēm:
|
Apgalvojuma Nr. |
Atbildes variants jā/nē |
|
1. |
nē |
|
2. |
jā |
|
3. |
nē |
|
4. |
nē |
|
5. |
jā |
2.Izvēlies vienu, pareizo atbildes variantu no piedāvātajiem. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu.
|
1. Kurā no piedāvātajiem variantiem ierakstīti tikai metāli? |
|||
|
a. Na, B, Ca |
b. Na, Li, H |
c. Mg, K, Ba |
d. Cs, Si, Cu |
|
2. Cik litri oglekļa (IV) oksīda veidojas, ja divi litri oglekļa (II) oksīda izreaģē ar vienu litru skābekļa? |
|||
|
a. 1 |
b. 2 |
c. 3 |
d. 4 |
|
3. Kāda ir elementa Mn oksidēšanās pakāpe savienojumā K2MnO4? |
|||
|
a. +1 |
b. - 2 |
c. +6 |
d. +7 |
|
4. Kuru datumu uzskata par Ķīmisko elementu periodiskās sistēmas dzimšanas datumu? |
|||
|
a. 01.03.1869. |
b. 01.03.1861. |
c. 01.03.1961. |
d. 01.03.1991. |
|
5. Kāda ir dzelzs oksīda formula, ja dzelzs masas daļa tajā ir 70%? |
|||
|
a. FeO |
b. FeO.Fe2O3 |
c. Fe3O4 |
d. Fe2O3 |
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants |
|
1. |
c |
|
2. |
b |
|
3. |
c |
|
4. |
a |
|
5. |
d |
3. Izmantojot piedāvātus zinātnieku vārdus (atslēgas vārdus), uzraksti pareizu tekstu par ķīmijas tematu. Atbildi pieraksti, izveidojot ciparu un atslēgas vārdu burtu virkni (piemēram, 1a,2e, un t.t).
Atslēgas vārdi: a. J.J.Bercēliuss, b. Dž.Daltons, c. D.Mendeļējevs, d.L.J.Meiers, e. Dž.A.Ņūlends, f. A.L.Lavuazjē.
XVIII gadsimtā beigās XIX gadsimta sākumā dabaszinātņu pētnieki ļoti nopietni pievērsās vielu uzbūves pētīšanai. Tā 1___ apstiprināja pieņēmumu, ka atoms ir vielas vismazākā daļiņa. Savukārt 2___ piedāvāja un arī izskaidroja jēdzienu „ķīmiskais elements”. Šīs skaidrojums valdīja ilgu laiku. Apzīmēt elementus ar mums labi pazīstamiem simboliem piedāvāja 3___. Viņš arī noteica atommasas vairāk nekā 40 elementiem, izmantojot pēc tā laika ļoti izsmalcinātas darba metodes. Laika gaitā zināmu elementu skaits sasniedza vairākus desmitus, un zinātniekiem kļuva vitāli svarīgu atrisināt problēmu - elementu klasifikāciju. Bija jāpiedāvā tāds variants, kurš atvieglotu ķīmiķu darbu, palīdzētu atcerēties īpašības, būtu unikāls un izmantojams visās valodas. XIX gadsimtā vairāki zinātnieki neatkarīgi viens no otra veidoja shēmas, tabulas un zīmējumus, kuri palīdzētu sagrupēt ķīmiskus elementus. 1864.gadā 4___ pirmo reizi sakārtoja visus zināmus atomus atommasas pieaugošā secībā. Bet, turpinot šo darbu, 5___ izveidoja oktāvas, novietojot elementus septiņos periodos. 1869.gada 1.martā 6____ publicēja tabulu, kurā elementi tika sakārtoti atommasu pieaugošā secībā, bet ņemtas vērā arī elementu īpašības, kas ļāva noteikt likumsakarību un formulēt likumu. Mūsdienās Ķīmisko elementu periodiskā tabula atšķiras no vairāk nekā pirms140 gadiem izveidotās, pateicoties atoma uzbūves atklājumiem, tā ir būtiski papildināta un pilnveidota.
Atbilde: 1b,2f,3a,4d,5e,6c.
4. No piedāvātajiem variantiem izvēlies vienu vai vairākus pareizu atbilžu variantus. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu vai burtu virkni.
|
1.Kādi oksīdi, nonākot atmosfērā, var izraisīt „skābo lietu”? |
|||||
|
a. NO |
b. SO2 |
c. N2O |
d. SiO2 |
||
|
2. Ar kurām no dotajām vielām reaģē CaO? |
|||||
|
a. BaO |
b. H2O |
c. NaOH |
d. HCl |
||
|
3. Kuras no dotajām vielām, reaģējot sava starpā, veido sāli? |
|||||
|
a. K2O un CO2 |
b. K2O un H2O |
c. SO3 un BaO |
d. SO3 un H2O |
||
|
4. Kas ir oksidētājs ķīmiskajā reakcijā: Zn + 2HCl |
|||||
|
a. Zn |
b. H |
c. Cl |
|||
|
5. Reakcijas starp kurām vielām ir oksidēšanās-reducēšanās reakcijas? |
|||||
|
a. CaO un H2O |
b. CuO un HCl |
c. C un O2 |
d. NO2 un H2O |
||
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants/-i |
|
1. |
a,b |
|
2. |
b,d |
|
3. |
a,c |
|
4. |
b |
|
5. |
c,d |
5. Katram no piedāvātam simbolam izvēlies atbilstošu ķīmiskā elementa oksidēšanas pakāpju variantus savienojumos. Atbildi pieraksti blakus formulas numuram, pievienojot vielas nosaukuma burtu. Uzdevuma risināšanai izmanto Ķīmisko elementu periodisko tabulu.
|
Elementu simboli |
|
Oksidēšanās pakāpes |
|
1. F |
A +2, +3 |
|
|
2.Fe |
B -2, +4, +6 |
|
|
3. S |
C +1,-1 |
|
|
4. H |
D -4, +4 |
|
|
5. C |
E -1 |
|
|
|
F -4,+2,+4 |
Vieta atbildēm:
|
Elementa simbola Nr. |
Oksidēšanās pakāpes burts |
|
1. |
E |
|
2. |
A |
|
3. |
B |
|
4. |
C |
|
5. |
F |
Elektrolītiskā disociācija
Temats: Elektrolītiskā disociācija
1. Izlasi apgalvojumu un atzīmē jā, ja apgalvojums ir patiess un nē, ja apgalvojums ir kļūdains. Atbildi pieraksti blakus apgalvojuma numuram, ierakstot jā vai nē.
|
Nr. |
Apgalvojums |
jā/nē |
|
1. |
Elektrolīti ir vielas, kas kausējumos un ūdens šķīdumos vada elektrisko strāvu. |
|
|
2. |
HCl, NaOH un KCl ir stiprie elektrolīti. |
|
|
3. |
Bāziskā šķīduma vidē pH ir <7. |
|
|
4. |
K2SO4 šķīdumā vide ir stipri bāziskā. |
|
|
5. |
Ja šķīduma vides pH=5,5, tad lakmuss ir sarkanā krāsa. |
|
Vieta atbildēm:
|
Apgalvojuma Nr. |
Atbildes variants jā/nē |
|
1. |
jā |
|
2. |
jā |
|
3. |
nē |
|
4. |
nē |
|
5. |
jā |
2.Izvēlies vienu, pareizo atbildes variantu no piedāvātajiem. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu.
|
1. Kura no dotajām vielām nav elektrolīts? |
|||||
|
a. HCl |
b. KCl |
c. Cl2 |
d. KOH |
||
|
2. Cik molu jonu ir šķīdumā, ja pilnībā disociē 1 mols K3PO4? |
|||||
|
a. 2 |
b.4 |
c.1 |
d.3 |
||
|
3. Ortofosforskābes disociācija notiek vairākos posmos. Kurus jonus var noteikt H3PO4 šķīdumā, ja tajā ir visu trīs disociācijas pakāpju joni. ? |
|||||
|
a. H+, H2PO4- , PO43- |
b. H+, HPO42-, PO43- |
c. H+, H2PO4-, PO43- |
d. H+, HPO42-, H2PO4- , PO43- |
||
|
4. Kāda vide ir K2SO3 šķīdumā? |
|||||
|
a. skāba |
b. bāziska |
c. neitrāla |
|||
|
5. Kāda augsnes vide nepieciešama lielākai augu daļai, lai tie normāli attīstītos? |
|||||
|
a. skāba |
b. bāziska |
c. neitrāla |
|||
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants |
|
1. |
c |
|
2. |
b |
|
3. |
d |
|
4. |
b |
|
5. |
a |
3. Izmantojot piedāvātos atslēgas vārdus (zinātnieku uzvārdi, skaitļi, gadi), uzraksti pareizo tekstu par ķīmijas tematu. Atbildi pieraksti, izveidojot ciparu un atslēgas vārdu burtu virkni (piemēram, 1a,2e, un t.t).
Atslēgas vārdi: a. <7, b. 7,5, c.V.Ostvalds, d. 1887.gads, e.S.Arrēniuss, f. 1903.gads, g. >7, h. 5,5.
Elektrolītiskās disociācijas teorijas autors ir 1___, kas neilgu laiku strādāja arī Rīgā kopā ar 2___. Elektrolītiskās disociācijas teorija bija formulēta 3___ un zinātnieki to nav atzinuši. Pēc vairākiem gadiem, kad teorijas idejas tika pierādītas, S. Arrēniusam bija piešķirta Nobeļa prēmija. Tas notika 4___. Šodien mēs zinām, ka disociācijas rezultātā disociē arī ūdens molekulas. Ūdeņraža jona koncentrāciju šķīdumā nosaka, izmantojot ūdeņraža eksponentu - pH. Ja šķīduma vide ir bāziska, tad šķīduma pH 5___, bet ja vide ir skāba, tad pH 6___. Kaut gan destilētā ūdens pH jābūt 7, uzglabājot ūdens reaģē ar gaisā esošo oglekļa (IV) oksīdu un pH sasniedz radītāju pat līdz 7___. Savukārt jūras un okeānos izšķīdinātie sāļi maina pH un tā parasti ir vairāk par 8___.
Atbilde: 1e,2c,3d,4f,5g,6a,7h,8b.
4. No piedāvātajiem variantiem izvēlies vienu vai vairākus pareizu atbilžu variantus. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu vai burtu virkni.
|
1.Kādas daļiņas hidratējas NaCl disociācijas rezultātā? |
|||
|
a. Na |
b. Na+ |
c. Cl |
d. Cl- |
|
2. Cilvēka darbības rezultātā pilsētas atmosfēra tika piesārņota ar SO2. Kādus anjonus var konstatēt analizējot nokrišņu ūdeni? |
|||
|
a. OH- |
b. H+ |
c. HSO3- |
d. SO32- |
|
3. Kuri katjoni atrodas K2CO3 šķīdumā? |
|||
|
a. K+ |
b. HCO3- |
c. OH- |
d. H+ |
|
4. Uz iepakojuma dota informācija par ūdenī esošajiem joniem. Viens no pierakstiem ir kļūdains. Kurā pierakstā ir kļūda? |
|||
|
a. K+, Na+, Ca2+, HCO3-, Cl- |
b. K+, Na+, Mg2+, SO42-, HCO3-, |
c. K+, Na+, Ag+, |
d. K+, Na+, Ca2+, Mg2+, HCO3-, Cl- |
|
5. Pēc melleņu ogu lasīšanas Guntars rokas noskaloja ar vēsu ūdeni, tad ieberza nedaudz citronskābes un noskaloja ar lielu ūdens daudzumu. Ūdens kļuva spilgti rozā krāsā. Par ko liecina krāsas maiņa? |
|||
|
a. Citronskābe maina savu krāsu uz rozā. |
|||
|
b. Mellenēs esošais pigments ir rozā krāsā. |
|||
|
c. Mellenēs esošais pigments maina krāsu uz rozā bāziskā vidē. |
|||
|
d. Mellenēs esošais pigments maina krāsu uz rozā skābā vidē. |
|||
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants/-i |
|
1. |
b,d |
|
2. |
c,d |
|
3. |
a |
|
4. |
c |
|
5. |
d |
5. Katrai no piedāvātajām elektrolītu formulām izvēlies atbilstošu grupu. Atbildi pieraksti blakus formulas numuram, pievienojot elektrolīta iedalījumam atbilstošu burtu.
|
Vielu ķīmiskās formulas |
|
Elektrolītu iedalījums |
|
1.HCl |
A stiprs elektrolīts |
|
|
2.Ca(OH)2 |
||
|
3. AgCl |
B vidēji stiprs elektrolīts |
|
|
4. H2CO3 |
||
|
5. H3PO4 |
C vājš elektrolīts |
|
|
6. NaOH |
Vieta atbildēm:
|
Vielu ķīmiskās formulas Nr. |
Elektrolītu iedalījuma burts |
|
1. |
A |
|
2. |
B |
|
3. |
C |
|
4. |
C |
|
5. |
B |
|
6. |
A |
Reakcijas elektrolītu šķīdumos
Temats: Reakcijas elektrolītu šķīdumos.
1. Izlasi apgalvojumu un atzīmē jā, ja apgalvojums ir patiess un nē, ja apgalvojums ir kļūdains. Atbildi pieraksti blakus apgalvojuma numuram, ierakstot jā vai nē.
|
Nr. |
Apgalvojums |
jā/nē |
|
1. |
Ķīmiskā reakcija starp elektrolītiem notiek, ja reakcijas rezultātā izdalās gāzveida viela, rodas nogulsnes vai rodas vājš elektrolīts. |
|
|
2. |
Oksidēšanās-reducēšanās reakcijās pievienoto un zaudēto elektronu skaits ir vienāds |
|
|
3. |
Neitralizācijas reakcijas ir aktīvo metālu reakcija ar ūdeni. |
|
|
4. |
No vienvērtīgajām bāzēm bāziskie sāļi neveidojas |
|
|
5. |
Lauksaimniecībā kaļķo augsni, lai paaugstinātu tās skābumu. |
|
Vieta atbildēm:
|
Apgalvojuma Nr. |
Atbildes variants jā/nē |
|
1. |
jā |
|
2. |
jā |
|
3. |
nē |
|
4. |
jā |
|
5. |
nē |
2.Izvēlies vienu, pareizo atbildes variantu no piedāvātajiem. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu.
|
1. Kāda sāls rodas, ja Ca(OH)2 un H2SO4 reaģē molu attiecībā 1:1? |
|||||
|
a. Ca (HSO4)2 |
b. CaSO4 |
c. (CaOH)2SO4 |
|||
|
2. Ar kādu oksidēšanas pakāpi sērs reakcijās var būt tikai oksidētājs? |
|||||
|
a. S-2 |
b. S0 |
c. S+4 |
d. S+6 |
||
|
3. Kurš ir reducētājs reakcijā Fe + CuSO4 |
|||||
|
a. Fe |
b.Cu |
c.S |
d.O |
||
|
4. Kādas vielas rodas, ja sāls reaģē ar sāli? |
|||||
|
a. sāls un bāze |
b. sāls un skābe |
c. sāls un sāls |
d. bāze un skābe |
||
|
5. Kurš no procesiem nav oksidēšanās-reducēšanās process? |
|||||
|
a. korozija |
b. degšana |
c. neitralizācija |
d. elektrolīze |
||
| |
|
|
|
|
|
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants |
|
1. |
b |
|
2. |
d |
|
3. |
a |
|
4. |
c |
|
5. |
c |
3. Izmantojot piedāvātos atslēgas vārdus un formulas, uzraksti pareizu tekstu par ķīmijas tematu. Atbildi pieraksti, izveidojot ciparu un atslēgas vārdu burtu virkni (piemēram, 1a,2e, un t.t).
Atslēgas vārdi: a. Skābais sāls, b.H+, c.H2O, d. Neitralizācijas reakcija, e.OH-, f. Normālais sāls, g. Bāziskais sāls.
Reakcijas starp bāzēm un skābēm mēs saucam par 1.___ . Šīs reakcijas var attēlot ar saīsinātu jonu vienādojumu kur H+ joni reaģē ar 2.___ joniem veidojot mazdisociējošas 3___ molekulu. Ja neitralizācijas reakcijas rezultātā visi OH- joni ir saistīti ar 4___ joniem un veidojas sāls, kas sastāv tikai no metāla joniem un skābes atlikuma joniem, tad tādu sāli sauc par 5___. Ja sāli veido metāla joni, ūdeņraža joni un skābes atlikuma joni, tad tas ir 6__, bet, ja sāls sastāvā ir metāla joni, hidroksīdjoni un skābes atlikuma joni, tad tas ir 7___ .
Atbilde: 1d,2e,3c,4b,5f,6a,7g.
4. No piedāvātajiem variantiem izvēlies vienu vai vairākus pareizos atbilžu variantus. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu vai burtu virkni.
|
1. Kādi joni paliek šķīdumā, ja NaCl šķīdumam pielej klāt K2SO4šķīdumu attiecībā 2:1? |
|||||
|
a. Na+, Cl-, SO42- |
b. Na+, K+, SO42- |
c. Na+, K+, Cl-, SO42- |
|||
|
2. Cik liela nogulšņu masa veidosies, ja 10 grami bārija hlorīda reaģēs ar 10 gramiem nātrija sulfāta? |
|||||
|
a. 10,00 grami |
b. 20,00 grami |
c. 16,31 grami |
d. 11,65 grami |
||
|
3. Kādi joni veidojas, ja disociē skābais sāls? |
|||||
|
a. metāla jons |
b. skābes atlikuma jons |
c. ūdeņraža jons |
d. hidroksīdjons |
||
|
4. Starp kādām vielām ir iespējama ķīmiska reakcija, ja saīsinātais jonu vienādojums ir H+ + OH- |
|||||
|
a. KOH un SO3 |
b. KOH un H2SO4 |
c. K2O un H2SO4 |
d. HCl un NaOH |
||
|
5. Uzlejot uz dzeramo sodu etiķskābi novērojam gāzveida vielas izdalīšanos. Kāda gāze izdalās? |
|||||
|
a. CO2 |
b. CO |
c.O2 |
d.N2 |
||
| |
|
|
|
|
|
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants/-i |
|
1. |
c |
|
2. |
d |
|
3. |
a,b,c |
|
4. |
b,d |
|
5. |
a |
5. Katrai no piedāvātajām formulām izvēlies atbilstošo vielas nosaukumu. Atbildi pieraksti blakus formulas numuram, pievienojot vielas nosaukuma burtu.
|
Vielu ķīmiskās formulas |
|
Vielas nosaukums pēc IUPAC |
|
1. NaHCO3 |
A Vara (II) sulfāta pentahidrāts |
|
|
2. (CuOH)2 CO3 |
B Kālija permanganāts |
|
|
3. CuSO4.5H2O |
C Nātrija hidrogēnkarbonāts |
|
|
4. KMnO4 |
D Kālija alumīnija sulfāts |
|
|
5. KAl(SO4)2 |
E Vara (II) hidroksokarbonāts |
|
|
|
F Kālija hidrogēnkarbonāts |
Vieta atbildēm:
|
Formulas Nr. |
Vielas nosaukuma burts |
|
1. |
C |
|
2. |
E |
|
3. |
A |
|
4. |
B |
|
5. |
D |
Ķīmisko reakciju norise
Temats: Ķīmisko reakciju norise
1. Izlasi apgalvojumu un atzīmē jā, ja apgalvojums ir patiess un nē, ja apgalvojums ir kļūdains. Atbildi pieraksti blakus apgalvojuma numuram, ierakstot jā vai nē.
|
Nr. |
Apgalvojums |
jā/nē |
|
1. |
Ja ķīmiskās reakcijas rezultātā siltums tiek patērēts, tad reakcija ir eksotermiska. |
|
|
2. |
Vielas, kas paātrina ķīmiskās reakcijas gaitu, sauc par inhibitoriem. |
|
|
3. |
Stāvoklis, kad tiešās reakcijas ātrums ir vienāds ar pretreakcijas ātrumu, ir ķīmiskais līdzsvars. |
|
|
4. |
Katalizatora klātbūtne paātrina ķīmiskās reakcijas gaitu, bet neietekmē ķīmisko līdzsvaru. |
|
|
5. |
Amonjaka iegūšanas reakcija ir apgriezeniska. |
|
Vieta atbildēm:
|
Apgalvojuma Nr. |
Atbildes variants jā/nē |
|
1. |
nē |
|
2. |
nē |
|
3. |
jā |
|
4. |
jā |
|
5. |
jā |
2.Izvēlies vienu, pareizo atbildes variantu no piedāvātajiem. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu.
|
1. Sērskābes ražošanā viens no posmiem var būt atspoguļots ar ķīmiskās reakcijas vienādojumu: S + O2 |
|||||
|
a. paātrina |
b. palēnina |
c. temperatūras izmaiņas reakcijas gaitu neietekmē |
|||
|
2. Eksperimenta gaitā iegūti četri rezultāti: 1. - 2,13; 2. - 2,15; 3. - 1,78 un 4. - 2,12. Kādi rezultāti jāņem vērā vidējā rādītāja noteikšanai? |
|||||
|
a. visus četrus |
b. 1.,2. un 3. |
c. 1., 3. un 4. |
d. 1.,2. un 4. |
||
|
3. Kura ķīmiskā elementa savienojumu klātbūtne degviela „saindē” izpūtēja katalizatoru? |
|||||
|
a. C |
b. N |
c. S |
d. H |
||
|
4. Kur tiek izmantota lielākā daļa iegūtā amonjaka ? |
|||||
|
a. Neilona |
b. Minerālmēslu |
c. Slāpekļskābes |
|||
|
5. Apgriezenisko reakciju atspoguļo reakcijas vienādojums: PCl3(g) + Cl2 (g) |
|||||
|
a. Palielināt spiedienu un palielināt temperatūru |
|||||
|
b. Palielināt spiedienu un pazemināt temperatūru |
|||||
|
c. Pazemināt spiedienu un palielināt temperatūru |
|||||
|
d. Pazemināt spiedienu un pazemināt temperatūru |
|||||
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants |
|
1. |
a |
|
2. |
d |
|
3. |
c |
|
4. |
b |
|
5. |
b |
3. Izmantojot piedāvātos atslēgas vārdus, uzraksti pareizo tekstu par ķīmijas tematu. Atbildi pieraksti, izveidojot ciparu un atslēgas vārdu burtu virkni (piemēram, 1a,2e, un t.t). Iegaumē, ka vienu atslēgas vārdu var izmantot vairākas reizes.
Atslēgas vārdi: a. Spiediens, b. Koncentrācija, c. Temperatūra, d.Sasmalcināšanās pakāpe.
Zināms, ka ķīmisko reakciju ātrumu ietekmē vairāki faktori. Piemēram, palielinoties 1___ par katriem 10 grādiem, reakcijas ātrums palielinās 2 līdz 4 reizes. Ja reakcijā piedalās cieta viela, svarīga ir šīs vielas 2__, bet, ja reakcijās izmanto šķīdumus, ļoti svarīga ir vielu 3__ tajos. Ja reakcija notiek starp gāzveida vielām, tad palielinot 4__, mēs palielinām vielu 5__ un līdz ar to paātrinām reakcijas gaitu.
Atbilde:1c,2d,3b,4a,5b.
4. No piedāvātajiem variantiem izvēlies vienu vai vairākus pareizu atbilžu variantus. Atbildi pieraksti blakus jautājuma numuram, pievienojot atbildes burtu vai burtu virkni.
|
1. Kāda ir koeficientu summa saīsinātajā jonu vienādojumā, ja Ba(OH)2 reaģē ar H2SO4? |
|||
|
a. 1 |
b.3 |
c.2 |
d.4 |
|
2.Kuri no piedāvātājiem joniem nevar eksistēt šķīdumā kopā? |
|||
|
a. K+,Na+,OH-, |
b. Na+, Cl-, SO42- |
c. Ca2+,Cl-,SO42- |
d.Ca2+, Cl-. NO3- |
|
3. Par kādām no piedāvātajam vielām automobiļu izpūtējos esošais katalizators pārveido NO un CO? |
|||
|
a. CH4 |
b. CO2 |
c.NH3 |
d.N2 |
|
4. Sērskābes ražošanā viens no posmiem var būt atspoguļots ar ķīmiskās reakcijas vienādojumu: S + O2 à SO2. Šajā procesā tiek patērēti 297 kJ/mol enerģijas. Kādi no piedāvātajiem apstākļiem paātrina reakcijas gaitu? |
|||
|
a. temperatūra |
b. katalizators, |
c. vielas sasmalcināšana |
d. spiediens |
|
5. Kuri no piedāvātājiem apstākļiem ietekmē ķīmisko reakciju līdzsvara nobīdi? |
|||
|
a. temperatūra |
b. katalizators |
c. saskarsmes virsma |
d. koncentrācija |
Vieta atbildēm:
|
Jautājuma Nr. |
Atbildes variants/-i |
|
1. |
b |
|
2. |
c |
|
3. |
a,b,c |
|
4. |
b,d |
|
5. |
a,c |
5. Izmantojot informāciju no ķīmisko reakciju vienādojumiem, pierakstiet katrai no piedāvātajām ķīmiskajām reakcijām atbilstošu reakcijas veidu. Atbildi pieraksti blakus ķīmisko reakciju vienādojuma numuram, pievienojot reakcijas veida (veidu) burtu.
Atceries, ka vienu un to pašu reakciju var klasificēt pēc dažādām pazīmēm, tāpēc vienam ciparam var būt atbilstoši vairāki burti.
Izmanto tikai to informāciju, kura ir dota ķīmisko reakciju vienādojumu pierakstos!
|
Ķīmisko reakciju vienādojums |
|
Reakcijas veids |
|
1. N2 + O2 |
A Eksotermiskā reakcija |
|
|
2. Fe3O4 (kr) + 4CO (g) |
B Endotermiskā reakcija |
|
|
3. 2H2O2 |
C Katalitiskā reakcija |
|
|
4. C (kr)+ O2 (g) |
D Apgriezeniskā reakcija |
|
|
5. N2 (g) + H2 (g) |
E Neapgriezeniskā reakcija |
Vieta atbildēm:
|
Formulas Nr. |
Vielas nosaukuma burts |
|
1. |
B,D |
|
2. |
B,C,D |
|
3. |
C,E |
|
4. |
A,E |
|
5. |
A,C,D |