Aldehīdi un ketoni
| Site: | Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu kompetences paaugstināšana |
| Course: | ĶīmiT026 : Mūsdienīgs un atvērts mācību process ķīmijā profesionālajā izglītībā |
| Book: | Aldehīdi un ketoni |
| Printed by: | Guest user |
| Date: | Friday, 20 February 2026, 8:04 PM |
Description
Aldehīdi un ketoni (D. Cēdere)
Table of contents
- 1. Titullapa
- 2. Ievads
- 3. Ogļūdeņražu karbonilatvasinājumi
- 4. Aldehīdu un ketonu molekulu uzbūve un nosaukumi
- 5. Patstāvīgais darbs. Alkanālu molekulu uzbūve un homologu rinda
- 6. Ķīmiskās īpašības
- 7. Demonstrējumi. Acetons kā šķīdinātājs. Sudraba spoguļa reakcija
- 8. Svarīgākie pārstāvji
- 9. Formaldehīds
- 10. Prezentācija. Aldehīdi un ketoni
1. Titullapa



D.Cēdere
Aldehīdi un ketoni
Materiāls izstrādāts
ESF Darbības programmas 2007. - 2013.gadam „Cilvēkresursi un nodarbinātība”
prioritātes 1.2. „Izglītība un prasmes”
pasākuma 1.2.1.„Profesionālās izglītības un vispārējo prasmju attīstība”
aktivitātes 1.2.1.2. „Vispārējo zināšanu un prasmju uzlabošana”
apakšaktivitātes 1.2.1.1.2. „Profesionālajā izglītībā iesaistīto pedagogu
kompetences paaugstināšana”
Latvijas Universitātes realizētā projekta
„Profesionālajā izglītībā iesaistīto vispārizglītojošo mācību priekšmetu pedagogu
kompetences paaugstināšana”
(Vienošanās Nr.2009/0274/1DP/1.2.1.1.2/09/IPIA/VIAA/003,
LU reģistrācijas Nr.ESS2009/88) īstenošanai.
Rīga, 2010
2. Ievads
Aldehīdi un ketoni
Aldehīdi un ketoni ir skābekli saturošie organiskie savienojumi, kurus var uzskatīt par spirtu un karbonskābju „starpniekiem”. Spirtus oksidējot, veidojas aldehīdi, kas tālāk oksidējas par karbonskābēm. Aldehīdi un ketoni ir sastopami dabā. Bieži vien to smarža nosaka dažādu augu un dzīvnieku specifiskos aromātus vai pilda kādu citu svarīgu funkciju dabā. Piemēram, aldehīds undekanāls ir dzimumferomons kodēm. Aldehīdi viegli oksidējas, tīrā veidā tie ir nestabili pat gaisa skābekļa iedarbībā. Dažus aldehīdus izmanto kulinārijā par aromātvielām. Pazīstamākais ketons ir acetons, to sadzīvē un tehnikā lieto par šķīdinātāju.
Sasniedzamais rezultāts
• Zina jēdzienus: ogļūdeņražu karbonilatvasinājums, aldehīds, ketons, alkanāls, alkanons, piesātināts aldehīds, piesātināts ketons, vienvērtīgs aldehīds, vienvērtīgs ketons.
• Izprot aldehīdu un ketonu molekulu uzbūvi.
• Nosauc vienvērtīgos piesātinātos aldehīdus atbilstoši Starptautiskajai (IUPAC) nomenklatūrai.
• Izprot aldehīdu oksidēšanas, reducēšanas un pievienošanas reakcijas.
• Raksta reakciju vienādojumus (atbilstoši prasītajiem reakciju veidiem) homologu rindu vispārīgajam loceklim, kas raksturo aldehīdu īpašības.
• Zina nosaukt svarīgākos aldehīdu un ketonu pārstāvjus un to nozīmi dabā un praktiskajā dzīvē.
• Izprot acetona nozīmi praktiskajā dzīvē un tā pareizas lietošanas nosacījumus.
• Zina aldehīdu un ketonu nozīmi izvēlētajā profesijā.
Metodiskas norādes skolotājam
Audzēkņi jau pazīst skābekli saturošos ogļūdeņražu atvasinājumus – spirtus, kurus sauc par hidroksilatvasinājumiem. Aldehīdi un ketoni ir ģenētiski cēlušies no spirtiem, tāpēc būtu svarīgi sākumā atgādināt audzēkņiem par etanola oksidēšanos par etanālu (acetaldehīdu), šādi nonākot pie jaunās organisko savienojumu klases – aldehīdiem un ketoniem. Aldehīdi un ketoni satur karbonilgrupu, tāpēc tos sauc par ogļūdeņražu karbonilatvasinājumiem.
Mācoties par aldehīdiem un ketoniem, galvenā vērība veltāma aldehīdu molekulu uzbūvei, reakciju vienādojumus rakstot galvenokārt ar vienkāršākajiem piesātinātajiem vienvērtīgajiem aldehīdiem (alkanāliem).
Aldehīdi, kas pārējo organisko vielu vidū izceļas ar vieglo oksidēšanās spēju, aktualizē oksidēšanās - reducēšanās pārejas organisko savienojumu vidū. Šajā tematā der atgādināt par spirtu oksidēšanos par aldehīdiem.
No vispārējās organisko savienojumu oksidēšanās shēmas (piemēram, alkāns → alkanols → alkanāls → alkānskābe → oglekļa(IV) oksīds + ūdens) praktiski nozīmīgākā ir spirtu oksidēšanās par karbonskābi, kurā aldehīds ir starpprodukts:
spirts → aldehīds → karbonskābe
Apskatot šo reakciju virkni, ir svarīgi atcerēties, ka aldehīdi oksidējas daudz vieglāk nekā spirti, tāpēc, oksidējot spirtus, parasti iegūst karbonskābes.
Ikdienā visbiežāk sastopamies ar formaldehīdu un acetonu. Ar formaldehīdu sastopas celtniecības un būvmateriālu speciālisti, namdari, frizieri, kosmetologi. Acetonu kā universālu šķīdinātāju izmanto visās nozarēs, kur jāstrādā ar eļļām, līmēm, lakām, jāatdala vielas, kas nešķīst ūdenī.
Jāuzsver formaldehīda un acetona iespējamā kaitīgā iedarbība, drošas darba metodes un rīcība nelaimes gadījumā.
Ieteicams izmantot:
Patstāvīgais darbs. DL Alkanālu molekulu uzbūve un homologu rinda.
Demonstrējumi. DL Acetons kā šķīdinātājs. Sudraba spoguļa reakcija.
Informatīvais materiāls. IM Formaldehīds.
Datorprezentācija. PP Aldehīdi un ketoni
3. Ogļūdeņražu karbonilatvasinājumi
Aldehīdi un ketoni ir skābekli saturoši ogļūdeņražu atvasinājumi, kuru molekulās ir karbonilgrupa >C=O. Tos sauc par ogļūdeņražu karbonilatvasinājumiem.
4. Aldehīdu un ketonu molekulu uzbūve un nosaukumi
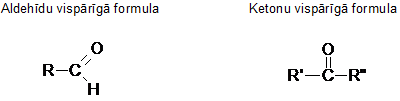
Aldehīdiem raksturīgā funkcionālā grupa ir aldehīdgrupa -CHO.
Aldehīdu un ketonu kopīgā funkcionālā grupa ir karbonilgrupa >C=O.
Nomenklatūra
Pēc IUPAC nomenklatūras piesātināto aldehīdu nosaukumus atvasina no alkānu nosaukumiem ar izskaņu -āls. Garāko oglekļa atomu virkni izvēlas tā, lai tajā atrastos funkcionālā grupa. Virkni numurē, sākot no aldehīdgrupas. Piesātināto ketonu nosaukumus veido analoģiski ar izskaņu -ons. Oglekļa atomu virkni numurē no tā gala, kur tuvāk ir funkcionālā grupa.
Aldehīdiem un ketoniem lieto arī triviālos nosaukumus. Arēnrindas (aromātiskajiem) pārstāvjiem pārsvarā lieto triviālos nosaukumus (skat. tabulu).
Aldehīdu un ketonu raksturojums
|
Struktūrformula |
Nosaukums |
Viršanas temperatūra, |
|||
|
|
pēc IUPAC |
triviālais |
°C |
||
|
Alkanāli (piesātinātie aldehīdi) |
|||||
|
H-CHO |
metanāls (formaldehīds) |
skudrskābes aldehīds |
-19 |
||
|
CH3-CHO |
etanāls (acetaldehīds) |
etiķskābes aldehīds |
21 |
||
|
CH3CH2-CHO |
propanāls |
propionskābes aldehīds |
49 |
||
|
CH3CH2CH2-CHO |
butanāls |
sviestskābes aldehīds |
76 |
||
|
CH3CH2CH2CH2-CHO |
pentanāls |
baldriānskābes aldehīds |
102 |
||
|
Alkanoni (piesātinātie ketoni) |
|||||
|
CH3-CO-CH3 |
propanons |
acetons, dimetilketons |
56 |
||
|
CH3-CO-CH2CH3 |
butanons |
metiletilketons |
80 |
||
|
CH3-CO-CH2CH2CH3 |
pentanons-2 |
metilpropilketons |
102 |
||
|
CH3CH2-CO-CH2CH3 |
pentanons-3 |
dietilketons |
102 |
||
|
Arēnrindas (aromātiskie) aldehīdi un ketoni |
|||||
|
C6H5-CHO |
benzolkarbaldehīds |
benzaldehīds |
179 |
||
|
C6H5-CO-CH3 |
1-feniletanons |
acetofenons |
202 |
||
5. Patstāvīgais darbs. Alkanālu molekulu uzbūve un homologu rinda
DL Alkanālu molekulu uzbūve un homologu rinda
Mērķis. Nostiprināt zināšanas par aldehīdu molekulu uzbūvi un izpratni par fizikālo īpašību maiņu homologu rindā.
Audzēkņiem sasniedzamais rezultāts
- Zina aldehīdu molekulu uzbūvi, apskatot to vienkāršāko homologu rindu – vienvērtīgos, piesātinātos aldehīdus – alkanālus.
- Prot prognozēt alkanālu kušanas un viršanas temperatūras, izmantojot to likumsakarīgu izmaiņu homologu rindā.
- Prot rakstīt aldehīdu struktūrformulas un summārās formulas.
Darba uzdevumi
1. Aizpildi tabulu, tukšajās vietās ierakstot trūkstošo!
|
Alkanāls |
Struktūrformula |
Saīsinātā struktūrformula |
Kušanas temperatūra |
Viršanas temperatūra |
Agregātstāvoklis 20 oC temperatūrā |
|
Metanāls |
|
|
|
|
|
|
Etanāls |
|
|
|
|
|
|
Propanāls |
|
|
-81 oC |
49 oC |
šķidrums |
|
Butanāls |
|
C3H7CHO |
-99 oC |
76 oC |
|
2. Uzraksti alkanālu funkcionālo grupu un nosauc to!
3. Uzraksti alkanālu vispārīgo formulu!
4. Kāpēc aldehīdi ir pieskaitāmi pie karbonilsavienojumiem?
5. Salīdzini alkanālu un atbilstošo alkanolu viršanas temperatūras, izmantojot tabulas! Izskaidro atšķirības!
Metodiskas piezīmes
Šo darbu ieteicams izmantot temata „Aldehīdi” ievadstundā, ja analoģiska pieeja izmantota iepriekš tematā „Spirti”.
6. Ķīmiskās īpašības
Aldehīdu un ketonu kopīgās ķīmiskās īpašības nosaka karbonilgrupa. Šiem savienojumiem raksturīgas pievienošanas reakcijas, kurās pārtrūkst >C=O grupas divkāršā saite.
Aldehīdu un ketonu atšķirīgā ķīmiskā īpašība - aldehīdi viegli oksidējas. Daudzi aldehīdi lēnām oksidējas ar gaisa skābekli, tos uzglabājot.
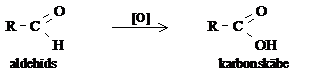
7. Demonstrējumi. Acetons kā šķīdinātājs. Sudraba spoguļa reakcija
DL Acetons kā šķīdinātājs. Sudraba spoguļa reakcijaDemonstrējums
Acetons kā šķīdinātājs
Mērķis. Veidot izpratni par dažādu vielu šķīdību acetonā, parādot demonstrējumus.
Audzēkņiem sasniedzamais rezultāts
- Pazīst acetonu pēc ārējā izskata.
- Secina par dažādu vielu šķīdību acetonā, pamatojoties uz eksperimenta novērojumiem.
Uzmanību! Strādāt velkmē! Acetons ir viegli uzliesmojošs šķidrums! Acetona tvaiki ir kaitīgi!
Reaģenti un materiāli: propanons (acetons), ūdens, heksāns, etilspirts, augu eļļa; 4 mēģenes ar aizbāžņiem.
Darba gaita
Četrās mēģenēs ielej pa 1 ml acetona. Pirmajā mēģenē pielej 0,5 ml ūdens, otrajā – 0,5 ml heksāna, trešajā – 0,5 ml etilspirta, ceturtajā – 0,5 ml augu eļļas. Mēģenes saskalina. Novēro, ka visas vielas acetonā šķīst labi.
Visās mēģenēs pielej 2-3 ml ūdens un saskalina. Dažās mēģenēs novēro šķīdumu saduļķošanos un pēc laika divu slāņu veidošanos.
Metodiskas piezīmes
Pievienojot ūdeni, otrajā, trešajā un ceturtajā mēģenē veidojas trīskomponentu maisījumi. Duļķošanos novēro, ja maisījums satur divus komponentus, kas savstarpēji praktiski nešķīst: ūdens un heksāns, ūdens un augu eļļa. Ja ūdens būs mazāk un acetons vairāk, tad noslāņošanās var nenotikt.
Demonstrējums
Sudraba spoguļa reakcija
Mērķis. Veidot izpratni par sudraba spoguļa reakciju, veicot demonstrējumu.
Audzēkņiem sasniedzamais rezultāts
- Pazīst formalīnu pēc ārējā izskata.
- Zina aldehīdu pierādīšanas reakciju.
- Izprot sudraba spoguļa reakciju kā oksidēšanas-reducēšanas reakciju.
- Secina par aldehīdu vieglo oksidēšanās spēju.
Reaģenti un materiāli: formalīns, sudraba spoguļa reaģents; 2 mēģenes, vārglāze ar karstu ūdeni.
Sudraba spoguļa reaģenta pagatavošana
A) Pie dažiem ml 2% AgNO3 šķīduma piepilina 10% amonjaka šķīdumu tik daudz, kamēr radušās nogulsnes tik tikko izšķīst (saskalinot). Maisījumam jābūt dzidram, taču amonjaku nedrīkst pielikt pārākumā.
B) Pie 5 ml 5% AgNO3 šķīduma pievieno 5 pilienus 10% NaOH šķīduma, tad pa pilienam maisot pievieno konc. amonjaka šķīdumu, līdz nogulsnes izšķīst.
Darba gaita
Pagatavotajam reaģentam pievieno 5 pilienus formalīna un saskalina. Mēģeni ievieto vārglāzē ar karstu ūdeni.
Svaigs formalīns veido spoguli pat bez sildīšanas.
2Ag+ + 2OH− + HCHO → 2Ag + H2O + HCOOH
(ja reaģentu gatavo pēc A varianta)
Metodiskas piezīmes
Lai sudrabs, kas izgulsnējas reakcijā, vienmērīgi noklātu mēģenes sieniņas, mēģenei, jābūt ļoti tīrai. Mēģeni pirms reakcijas var attaukot ar acetonu. Var izmazgāt ar mazgājamo līdzekli, pēc tam ar sārma šķīdumu un izskalot ar ūdeni.
Formaldehīds oksidējas ļoti viegli. Ja reakcija notiek pārāk strauji, sudrabs izgulsnējas amorfu nogulšņu veidā, un spogulis neveidojas, tāpēc formalīnu ieteicams atšķaidīt ar ūdeni. Spoguļa neveidošanās iemesls var būt arī pārāk strauja karsēšana.
Sudraba spoguļa veidošanos var veicināt, pievienojot nedaudz NaOH šķīduma.
Ja sārms ir pārākumā, tad reakcijas rezultātā veidojas nevis brīva skudrskābe, bet gan tās sāls – amonija formiāts vai attiecīgi nātrija formiāts.
8. Svarīgākie pārstāvji
Formaldehīds
Formaldehīds (metanāls, HCOH) ir vienkāršākais aldehīds, tā ir gāze ar izteiktu, asu smaku. Kairinoši iedarbojas uz acu un elpošanas orgānu gļotādu. Labi šķīst ūdenī. Formaldehīda ūdens šķīdumu (35-37%) sauc par formalīnu.Formaldehīda maksimāli pieļaujamā koncentrācija (MPK) gaisā = 0,12 mg/m3.
Formaldehīda bīstamības apzīmējumi pēc pašreizējās sistēmas:

Formaldehīda bīstamības apzīmējumi pēc GHS (globāli harmonizētās sistēmas), kas pilnībā būs spēkā 2015.gadā:


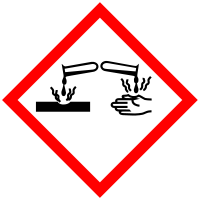
Formaldehīdu bieži lieto dažādu plaša patēriņa preču ražošanā, piemēram, tekstilrūpniecībā kā pretburzīšanās līdzekli, celtniecības materiālos, piemēram, ķīmiski apstrādātos kokmateriālos, kā arī dažādu plastmasu un citu vielu ražošanā. Formaldehīds ir plaši sastopams līmēs un apdares materiālos. Dažas nagu lakas un stiprinātāji arī satur formaldehīdu.
Acetaldehīds
Etanāls (acetaldehīds CH3CHO)Acetaldehīds ir viegli gaistošs, bezkrāsains šķidrums ar īpatnēju smaržu, kas lielākās koncentrācijās kļūst asa un nepatīkama. Acetaldehīdu izmanto etiķskābes, butadiēna, lielmolekulāro savienojumu, krāsvielu un ārstniecības vielu ražošanai.
Augstākos alkanālus, piemēram, dekanālu un 7-hidroksi-3,7-dimetiloktanālu izmanto par smaržvielām kosmētisko līdzekļu ražošanā.
Benzaldehīds C6H5CHO
Benzaldehīds ir viskozs šķidrums ar patīkamu rūgto mandeļu smaržu. Benzaldehīds gaisā strauji oksidējas. To izmanto smaržvielu, ārstniecības vielu un krāsvielu ieguvē.
4-Hidroksi-3-metoksibenzaldehīds (vanilīns)
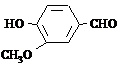
Vanilīns ir kristāliska viela ar patīkamu aromātu. Vanilīns sastopams dabā vaniļas koka pākstīs. To iegūst arī sintētiski. Izmanto kulinārijā un kosmētikā.
Kanēļskābes aldehīds C6H5-CH=CH-CHO
Kanēļskābes aldehīds ir kristāliska viela ar patīkamu aromātu. Dabā sastopams kanēļkoka mizā, no kurienes to iegūst, izmantojot ūdens tvaika destilāciju. Kanēļkoka mizas eļļa satur 42-68% kanēļaldehīda. Zemākas kvalitātes kanēļaldehīdu iegūst no kanēļkoka lapām. Kanēļskābes aldehīds ir kanēļa galvenā sastāvdaļa, to izmanto kulinārijā. Kulinārijā izmanto kanēļkoka mizas gabaliņus vai šo mizu, saberztu pulverī.
Kanēļskābes aldehīdu izmanto parfimērijā par smaržvielu, kas ietilpst noteiktu smaržu kompozīcijā.
Tīrā veidā kanēļaldehīdam ir sensibilizējošas īpašības, tas var izraisīt alerģisku reakciju. Augstā alerģijas potenciāla dēļ medicīnā to izmanto alerģijas testēšanā, lai noteiktu aromātvielu panesamību.
Acetons
Acetons (propanons, CH3COCH3) ir vienkāršākais un izplatītākais ketons. Acetons ir gaistošs, bezkrāsains, degošs šķidrums ar raksturīgu smaržu. Viršanas temperatūra 56 oC. Acetons labi sajaucas ūdeni un ar organiskajiem šķīdinātājiem.
Acetons ir svarīga izejviela ķīmiskajā rūpniecībā. To izmanto galvenokārt polimetilmetakrilāta (PMMA) jeb organiskā stikla ražošanā.
Acetons ir viens no visizplatītākajiem šķīdinātājiem. To izmanto par šķīdinātāju laboratorijās, rūpniecībā un arī sadzīvē. Acetonu lieto par šķīdinātāju un ekstrahēšanas līdzekli sveķiem, taukiem, eļļām, celulozes acetātam. Acetons šķīdina vairākus polimērus, tāpēc to izmanto polimērmateriālu līmēšanai, acetonu saturošus šķīdumus izmanto nagu lakas noņemšanai.

Acetons labi šķīdina polistirolu. Attēlā redzama viena acetona piliena iedarbība uz stiropora (putu-polistirola) parauga.
Acetons noder dažādu virsmu un ierīču tīrīšanai pēc poliuretāna putu lietošanas. Acetonu lieto sīku metāla detaļu virsmu attaukošanai. Acetonu saturošus šķīdumus izmanto arī zobārstniecībā, piemēram, zobu kanālu tīrīšanā.
Toksiskā iedarbība. Acetons sausē ādu, jo to attauko. Tāpēc acetona skartā āda ir jāieeļļo. Acetona tvaiku ieelpošana lielākos daudzumos izraisa bronhu bojājumus, nogurumu un galvassāpes. Ļoti lielās koncentrācijās acetonam ir narkotiska iedarbība.
Acetona kaitīgās iedarbības raksturojums:
MPK = 500 ml·m−3, 1200 mg·m−3
LD50 = 5800 mg·kg−1 (žurkām orāli)